

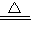 2Hg+O2↑;
2Hg+O2↑;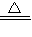 2Cu+CO2↑;
2Cu+CO2↑;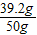 ×100%=78.4%
×100%=78.4%

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:初中化学 来源: 题型:
 学过金属的活动性顺序以后,东东对其一系列知识进行了研究.
学过金属的活动性顺序以后,东东对其一系列知识进行了研究.
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
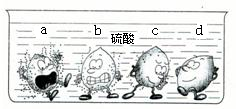 学过金属的活动性顺序以后,明明同学对其一系列知识进行了研究.
学过金属的活动性顺序以后,明明同学对其一系列知识进行了研究.| X盐溶液 | Y盐溶液 | Z盐溶液 | |
| Ni | 无 | 无 | 有 |
| Mn | 无 | 有 | 有 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 学过金属的活动性顺序以后,东东对其一系列知识进行了研究.
学过金属的活动性顺序以后,东东对其一系列知识进行了研究. 4Al2O3+9Fe.
4Al2O3+9Fe.查看答案和解析>>
科目:初中化学 来源:不详 题型:问答题
| ||
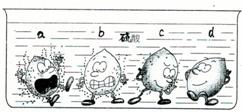
查看答案和解析>>
科目:初中化学 来源:2010年初中毕业班第三次调研测试化学试卷(解析版) 题型:解答题
| X盐溶液 | Y盐溶液 | Z盐溶液 | |
| Ni | 无 | 无 | 有 |
| Mn | 无 | 有 | 有 |
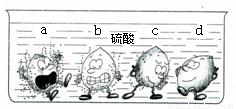
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com