
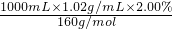 =0.1275mol;
=0.1275mol; =0.1275mol/L;
=0.1275mol/L;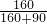 ×100%≈15.9g
×100%≈15.9g

 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
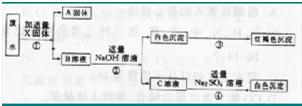
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?南宁)据2012年4月15日中央电视台《每周质量报告》报道,一些不法厂商使用重金属铬超标的工业明胶代替食用明胶来生产药用胶囊.
(2012?南宁)据2012年4月15日中央电视台《每周质量报告》报道,一些不法厂商使用重金属铬超标的工业明胶代替食用明胶来生产药用胶囊.查看答案和解析>>
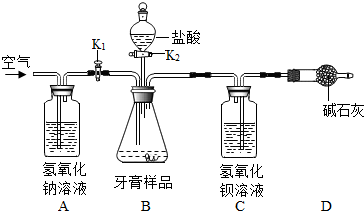
科目:初中化学 来源: 题型:阅读理解
| 实验次数 | 实验1 | 实验2 | 实验3 |
| C装置中沉淀质量(g) | 3.93 | 3.94 | 3.95 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 第一次 | 第二次 | 第三次 | |
| 加入稀硫酸的(g) | 24.50 | 24.50 | 24.50 |
| 烧杯中剩余固体(g) | 5.80 | 3.00 | 0.20 |
查看答案和解析>>
科目:初中化学 来源:2011年第二十一届“天原杯”全国初中学生化学素质和实验能力竞赛(湖北赛区)初赛试卷(解析版) 题型:解答题
| 加硫酸溶液的序号 | 加硫酸溶液的体积/ml | 剩余固体的质量/g |
| 1 | 30.0 | 10.52 |
| 2 | 30.0 | 6.04 |
| 3 | 30.0 | 2.2 |
| 4 | 30.0 | 0.6 |
| 5 | 30.0 | 0.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com