
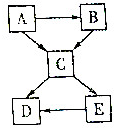
 现有A~E五种常见物质,且都含有同一种非金属元素,其中E广泛用于洗涤剂的生产,它们的转化关系如图,请回答:
现有A~E五种常见物质,且都含有同一种非金属元素,其中E广泛用于洗涤剂的生产,它们的转化关系如图,请回答:分析 有A~E五种常见物质,且都含有同一种非金属元素,其中E广泛用于洗涤剂的生产,E为碳酸钠;结合二氧化碳能与氢氧化钠溶液反应生成碳酸钠,碳充分燃烧生成二氧化碳,不充分燃烧生成一氧化碳,一氧化碳燃烧生成二氧化碳,则A为碳,B为一氧化碳,C为二氧化碳;二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,则D为碳酸钙;据此进行分析解答即可.
解答 解:有A~E五种常见物质,且都含有同一种非金属元素,其中E广泛用于洗涤剂的生产,E为碳酸钠;结合二氧化碳能与氢氧化钠溶液反应生成碳酸钠,碳充分燃烧生成二氧化碳,不充分燃烧生成一氧化碳,一氧化碳燃烧生成二氧化碳,则A为碳,B为一氧化碳,C为二氧化碳;二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,则D为碳酸钙.
(1)物质A为碳,其化学式C.
(2)B→C,即一氧化碳燃烧生成二氧化碳,反应的化学方程式为:2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2.
E→D,即碳酸钠与氢氧化钙溶液反应生成碳酸钙沉淀和氢氧化钠,反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH(合理即可).
(3)上述转化中碳充分燃烧生成二氧化碳,不充分燃烧生成一氧化碳,一氧化碳燃烧生成二氧化碳,均属于化合反应;碳与氧化铜在高温下反应也可以生成二氧化碳,同时生成铜,该反应属于置换反应.碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,该反应属于复分解反应.一定不涉及的基本反应类型是分解反应.
故答案为:(1)C;(2)2CO+O2$\frac{\underline{\;点燃\;}}{\;}$2CO2;Ca(OH)2+Na2CO3═CaCO3↓+2NaOH(合理即可);(3)分解反应.
点评 本题难度不大,解题时往往需要从题目中挖出一些明显或隐含的条件,抓住突破口(突破口往往是现象特征、反应特征等),获得结论,最后把结论代入原题中验证.


科目:初中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 实验结论 |
| (1)取少量固体于试管中,加适量水振荡后静置,再滴几滴无色酚酞试液 | 溶液变红 | 说明固体成分中一定含有 氧化钙 |
| (2)再取少量固体于另一试管中滴加过量稀盐酸 | 有气泡生成 | 说明固体成分中一定含有 碳酸钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 硫化丙烯由3个碳原子、6个氢原子、1个硫原子构成 | |
| B. | C3H6S的相对分子质量74g | |
| C. | C3H6S中碳元素的质量分数最大 | |
| D. | C3H6S中碳、氢、硫元素质量比为3:6:1 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 物质 | X | Y | Z | W |
| 反应前物质质量/g | 10 | 2.2 | 16.2 | 0.9 |
| 反应后物质质量/g | a | 4.4 | 8.1 | 1.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 序号 | 物 质 | 选用试剂 | 操作 |
| A | CO2(H2) | O2 | 点燃,通过浓硫酸干燥 |
| B | 稀HCl(稀H2SO4) | 过量的BaCl2 | 过滤 |
| C | KNO3溶液(KOH) | Cu(NO3)2溶液 | 过滤,蒸发 |
| D | NaOH溶液(Na2CO3) | 稀盐酸 | 加入试剂至不再产生气泡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com