
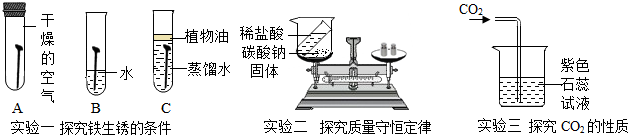
分析 (1)根据铁生锈的条件分析ABC中最易生锈的;植物油不溶于水可以隔绝空气;根据ABC的对比分析铁生锈的条件.
(2)根据盐酸与碳酸钠反应生成了二氧化碳气体,逸散到了空气中会使烧杯中物质的质量减少来分析解答.考虑密封装置.
(3)根据二氧化碳的性质进行分析,二氧化碳能与水反应生成碳酸,呈酸性,能使紫色石蕊试液变红.
解答 解:(1)A试管中没有水,管口闭塞,管内只有空气,铁钉不易生锈.B试管中铁钉浸在水里,管口未做任何处理,故铁钉同时和氧气、水接触,符合钢铁锈蚀条件,故最易生锈的是B试管;C试管中植物油不溶与水,且密度比水小,故可浮在水面,起到了隔绝空气的作用,铁钉虽浸在水里,但不同时具备氧气和水这两个条件,故铁钉也不易生锈.故填:B;与氧气、水同时接触(或在潮湿的空气中);
(2)反应后天平不平衡的原因是盐酸与碳酸钠反应生成氯化钠、水、二氧化碳,而烧杯是敞开的,所以生成的二氧化碳逸散到空气中使质量减小;若反应物不变,要使天平在反应后仍然保持平衡,可在烧杯口处套一个气球,使之在密封的容器内进行实验.故填:反应生成的CO2气体逸出烧杯;密闭容器;
(3)二氧化碳能与水反应生成碳酸,呈酸性,能使紫色石蕊试液变红,故填:红色;能与水反应生成碳酸.
点评 本题考查课本上的实验,让学生掌握课本中的基础实验是解答本题关键.


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:初中化学 来源: 题型:解答题
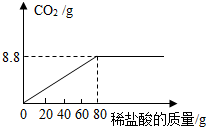 我州地处武陵山区,具有丰富的天然石灰石、大理石(主要成分是碳酸钙)资源,纯度高、硬度大,是优质的建筑材料.为测定某地天然大理石中碳酸钙的含量(杂质不与稀盐酸反应),某化学兴趣小组成员取25g样品,加入一定溶质质量分数的稀盐酸,测得的实验数据如图所示.
我州地处武陵山区,具有丰富的天然石灰石、大理石(主要成分是碳酸钙)资源,纯度高、硬度大,是优质的建筑材料.为测定某地天然大理石中碳酸钙的含量(杂质不与稀盐酸反应),某化学兴趣小组成员取25g样品,加入一定溶质质量分数的稀盐酸,测得的实验数据如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 8.0g | B. | 11.2g | C. | 16.0g | D. | 24.8g |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
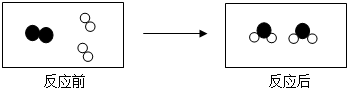
| A. | 化学反应中,原子没有发生变化 | B. | 该反应是化合反应 | ||
| C. | 有单质生成 | D. | 该反应中反应物有两种 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com