
【题目】如图是甲、乙两种物质的溶解度曲线,请回答下列问题。
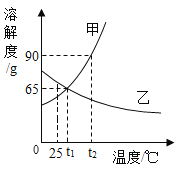
(1)_°C 时,甲、乙两种物质的溶解度相等。
(2)将乙的饱和溶液变成不饱和溶液的方法是_。(任写一种)
(3)t2°C时,分别将甲、乙两种物质的饱和溶液降温到t1°C,有晶体析出的是__,此时甲溶液的溶质质量分数_(填“大于”、“等于”或“小于”)乙溶液的溶质质量分数。
(4)小明同学用20ml 水(密度约为1g/ml )配制t1°C的甲饱和溶液:
①计算需要称量的甲的质量是____g。
②将称取的甲固体和20ml水倒入烧杯中,_(填操作名称),直至固体完全溶解。
【答案】t1 加水或降低温度 甲 大于 13 搅拌
【解析】
(1)据图可以看出,在t1℃时,甲、乙两种物质的溶解度相等,故填:t1;
(2)乙的溶解度随温度的升高而减小,要将乙的饱和溶液变成不饱和溶液可以采用加水或降低温度的方法,故填:加水或降低温度;
(3)甲的溶解度随温度降低而减小,乙的溶解度随温度降低而增大,所以t2℃时,分别将甲、乙两种物质的饱和溶液降温到t1℃,甲有晶体析出;乙的溶解度变大,溶质质量分数与降温前相等,据饱和时质量分数的计算式![]() ×100%,即溶解度越大质量分数也就越大,而t1℃甲的溶解度大于t2℃乙的溶解度,所以此时甲溶液的溶质质量分数大于乙溶液的溶质质量分数。故填:甲;大于;
×100%,即溶解度越大质量分数也就越大,而t1℃甲的溶解度大于t2℃乙的溶解度,所以此时甲溶液的溶质质量分数大于乙溶液的溶质质量分数。故填:甲;大于;
(4)①20ml水即20g水,t1℃时甲的溶解度为65g,即100g水中溶解65g甲刚好可以得到饱和溶液,所以20g水需要甲的质量为65g×![]() =13g。故填:13;
=13g。故填:13;
②将称取的甲固体和20ml水倒入烧杯中,用玻璃棒搅拌,直至固体完全溶解。故填:搅拌。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:初中化学 来源: 题型:
【题目】根据如图所示装置,回答有关问题:
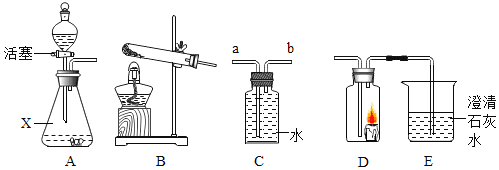
(1)装置A中,仪器X的名称为______,其中用分液漏斗代替长颈漏斗的优点是______。
(2)实验室常用氯酸钾制取氧气,发生装置应选择______![]() 填字母
填字母![]() ,反应的化学方程式是______
,反应的化学方程式是______
(3)若用装置C收集氢气,则氢气应从______![]() 填“a”或“b”
填“a”或“b”![]() 端导管口通入。
端导管口通入。
(4)乙炔是一种微溶于水的气体,密度与空气接近,实验室常用块状电石和水在常温下反应制取乙炔,故制取乙炔的发生装置选______。![]() 填装置序号
填装置序号![]()
(5)某同学点燃蜡烛,然后放入D中,迅速连接A、D、E,打开活塞进行实验,发现E中溶液逐渐变浑浊,则装置A中产生的气体______。![]() 填“一定”或“不一定”
填“一定”或“不一定”![]() 为二氧化碳气体。
为二氧化碳气体。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】石膏(CaSO42H2O)是一种用途广泛的工业材料和建筑材料,工业上用含SO2的烟气制备石膏的简要流程图如下:
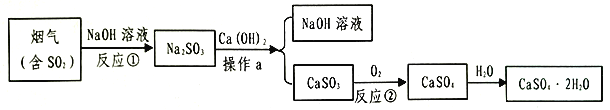
(1)在反应①时,常将NaOH喷成雾状的原因是___________________.
(2)操作a的名称是__________,在实验室里进行该操作,玻璃棒的作用是__________.
(3)CaSO3不易溶于水,它属于________(填“酸”、“碱”、“盐”或“氧化物”),其中硫元素的化合价为________,反应②的化学方程式是_________________________.
(4)生产流程中生成的______________可循环利用,节约成本.
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】“众志成城战疫情”,在抗击新型冠状病毒引发的肺炎疫情中大量使用84消毒液来进行消毒,84消毒液的主要成分是次氯酸钠(NaC1O)。下列关于次氯酸钠的说法中不正确的是( )
A.次氯酸钠中氯元素的化合价为+5价
B.次氯酸钠中氧元素的质量分数最小
C.次氯酸钠中钠、氯、氧三种元素的质量比为46:71:32
D.次氯酸钠由钠、氯、氧三种元素组成
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】结合下图实验装置,回答有关问题:

(1)指出图中a仪器的名称:_____。
(2)用高锰酸钾固体制取较纯净的氧气,选用的装置是____,反应的化学方程式为_____。
(3)实验室制取二氧化碳时,若用E装置干燥二氧化碳,则E中应盛放____,气体应从____(填“c”或“d”)端通入,若发生装置选用C装置来制取该气体,其优点是_____。
(4)二氧化氯(C1O2)用作消毒剂,C1O2是一种橙黄色,有刺激性气味的气体,11°C以下为红色气体,易溶于水,见光易分解。可用粉末状固体氯酸钠(NaC1O3)与浓盐酸反应制取C1O2,反应的化学方程式为:2NaClO3+4HCl=2ClO2↑+Cl2↑+2X+2NaCl
①制取C1O2气体的发生装置应选用______(填装置序号)装置。
②上述反应中X的化学式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
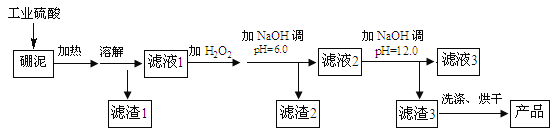
【题目】硼泥主要由MgO 和SiO2 组成,含有少量Fe2O3 、FeO 、Al2O3 等杂质。用硼泥生产氢氧化镁的工艺流程如图所示:
提示信息:
Ⅰ.加入H2O2的目的是将溶液中 Fe2+氧化为 Fe3+
Ⅱ.SiO2不与硫酸反应
Ⅲ.已知某些金属阳离子在溶液中生成氢氧化物沉淀的pH如下表所示,当溶液的pH达到完全沉淀值时,可以认为金属阳离子已完全沉淀。
氢氧化物 | 完全沉淀时的pH |
Mg(OH)2 | 10.8 |
Fe(OH)2 | 9.6 |
Fe(OH)3 | 3.7 |
Al(OH)3 | 4.7 |
(1)写出加热溶解中发生反应的其中一个化学方程式:____。
(2)滤液2中大量存在的金属离子是___。
(3)调节两次pH值的原因是___。
(4)利用Mg(OH)2与含SO2和O2的烟气反应生成MgSO4和另一种无污染的化合物,可以使烟气脱硫,请问另一种产物的化学式为___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室制取气体所需装置如下图所示。
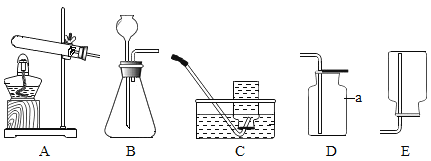
请回答以下问题:
(1)装置中标“a”的仪器名称是_____。
(2)用高锰酸钾制取氧气时,所选用的发生装置是_____,收集装置是C或_____。(填字母序号,下同)
(3)用大理石和稀盐酸制取二氧化碳时,所选用的发生装置是_____。该装置还可用于制氧气,其反应的化学方程式为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】分类和类比是学习化学常用的方法。
(1)下列实验都能探究酸与碱之间能否发生反应。请从“定性研究”或“定量研究”的角度,将下列实验中的A与_________(填字母)归为一类,理由是_____________。
|
在少量的氢氧化铜固体中加入足量的稀盐酸 |
在氢氧化钠溶液不断滴加稀硫酸,边加边用酸度计测定溶液的pH |
A | B | C |
(2)非金属与氢气反应的条件越容易、反应越剧烈,则非金属元素的非金属性越强。据此规律,可推断出第三周期非金属元素的非金属性强弱的顺序为__________________;结构决定性质,请归纳位于第三周期元素的原子结构与元素性质的递变规律______________________。
元素 | Si | p | S | Cl |
单质与氢气的反应条件 | 高温 | 磷蒸气与氢气能反应 | 加热 | 加热或点燃时发生爆炸 |
原子核外电子排布 |
|
|
|
|
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学用语是学习化学的重要工具。下面对化学用语含义的叙述正确的是( )
①H ②Fe ③![]() ④
④![]() ⑤2MgO
⑤2MgO
A. ③表示铁离子
B. 能表示一个分子的有④⑤
C. ②和③属于同种元素
D. ④表示![]() 由1个碳元素和2个氧元素组成
由1个碳元素和2个氧元素组成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com