
| 实验方案 | A 测溶液pH | B滴加Na2CO3溶液 | C滴加BaCl2溶液 |
| 实验操作 | 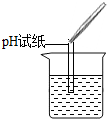 | 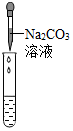 | 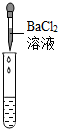 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 产生有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液显酸性 | 溶液中有H2SO4剩余 | 溶液中有H2SO4剩余 |
分析 【假设猜想】根据酸碱不能共存判断不合理的猜想;
【实验探究】根据碳酸钠和硫酸反应能生成二氧化碳气体,硫酸与氯化钡反应现象,溶液的酸碱性解答;
【评价反思】(1)根据图示操作判断,检测溶液的pH时,pH试纸不能伸入溶液中;
(2)检验一种物质时要排除其他物质的干扰,硫酸钠也能与氯化钡反应生成白色沉淀.
解答 解:【假设猜想】硫酸和氢氧化钠反应生成硫酸钠和水,酸或碱可能过量,也可能恰好反应,恰好反应后溶液中的溶质为硫酸钠,故猜想一为氢氧化钠和硫酸钠及硫酸,酸碱不能同时过量,因为酸碱不能共存,会继续反应,故猜想四不合理;
【实验探究】(1)硫酸铜和氢氧化钠反应能生成氢氧化铜蓝色沉淀,因此溶液中滴加几滴CuSO4溶液,无明显变化,说明溶液中一定没有氢氧化钠.
(2)溶液中有硫酸,滴加碳酸钠后,碳酸钠会和硫酸反应生成二氧化碳气体,因此会看到产生气泡.硫酸与氯化钡反应生成硫酸钡白色沉淀;pH<7溶液为酸性;
【评价反思】(1)根据图示操作判断,检测溶液的pH时,pH试纸不能伸入溶液中,应用玻璃棒蘸取少量溶液涂到pH试纸上;
(2)检验一种物质时要排除其他物质的干扰,硫酸钠也能与氯化钡反应生成白色沉淀,故不能证明溶液中一定存在硫酸;
故答案为:【假设猜想】猜想四;H2SO4和NaOH在溶液中不能共存;
【实验探究】(1)NaOH;(2)有气泡产生;白色沉淀;酸;
【评价反思】pH试纸浸入溶液中;Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在.
点评 此题通过中和反应考查了化学方程式的书写,实验方案设计、实验操作以及实验方案的评价,解答时要全面审题,认真解答.


科目:初中化学 来源: 题型:实验探究题
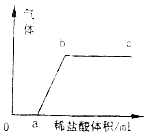 已知往碳酸钠溶液逐滴滴入稀盐酸会依次发生以下两个反应:Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑.现有一包由氢氧化钠和碳酸钠组成的固体粉末,将该粉末加入足量水中充分溶解,往所得溶液中逐滴滴入稀盐酸,产生气体与所加稀盐酸有如图所示的关系.根据以上所述现象回答:
已知往碳酸钠溶液逐滴滴入稀盐酸会依次发生以下两个反应:Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl=NaCl+H2O+CO2↑.现有一包由氢氧化钠和碳酸钠组成的固体粉末,将该粉末加入足量水中充分溶解,往所得溶液中逐滴滴入稀盐酸,产生气体与所加稀盐酸有如图所示的关系.根据以上所述现象回答:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
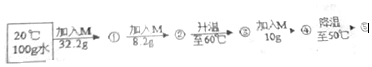
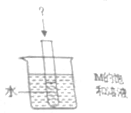 已知M物质和氯化钠的溶解度与温度的关系如表所示
已知M物质和氯化钠的溶解度与温度的关系如表所示| 温度/℃ | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | 物质M | 32.2 | 37.4 | 40.4 | 50.4 | 55.2 |
| 氯化钠(NaCl) | 35.7 | 35.8 | 36 | 36.3 | 36.6 | |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 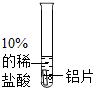 |  |
| 实验现象 | 铝片表面有气泡产生 | 没有明显现象 |
| 操作步骤(用图示说明或文字叙述均可) | 可能观察到的实验现象 | 相应的结论 |
| 用砂纸把铝片打磨后放入10%的稀硫酸中 | 铝片表面有气泡产生 | 我的猜想正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | O2和CO2分别通过灼热氧化铜 | B. | CO和CO2分别通入澄清石灰水 | ||
| C. | H2和CO2分别通入紫色石蕊试液 | D. | CO和O2分别通过灼热氧化铜 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com