
【题目】【2016年四川省资阳市】某食用纯碱中含有少量的氯化钠,为测定该纯碱中碳酸钠(Na2CO3)的含量,现取该纯碱样品12.5g,加入150.0g稀盐酸溶液恰好完全反应,测得反应后溶液总质量变成158.1g。
计算:(1)反应中产生二氧化碳的质量为 ;
(2)纯碱样品中Na2CO3的质量分数。
科目:初中化学 来源: 题型:
【题目】【2016年湖北省十堰市】甲乙两同学在学习酸的化学性质时做了如图所示实验:

甲同学实验时没有观察到明显现象,乙同学实验时观察到有气泡发生:甲乙同学将反应完成后试管中的溶液倒入,洁净的废液杯中,没有观察到明显现象.
【提出问题】废液杯中溶液的溶质是什么?
【猜想与假设】猜想1:废液中含有的溶质为NaCl、CaCl2
猜想2:废液中含有的溶质为NaCl、CaCl2、HCl
猜想3:废液中含有的溶质为________(写化学式)
【验证与探究】甲同学取少量废液于试管中,加入紫色石蕊试液,溶液变红,则猜想________正确;乙同学取少量的废液于试管中,加入适量氧化铁粉末,发现溶液变黄色,发生反应的化学方程式为________.
【表达与交流】甲乙同学都认为将该溶液直接排放会对环境造成危害,你认为处理该废液的最佳方法是________.
【归纳与总结】确定反应后溶液中溶质的成分,除了要考虑生成物外,还要考虑________.
【拓展与延伸】乙同学在实验完毕后查阅资料得知:少量盐酸与碳酸钠溶液反应能产生碳酸氢钠(反应的化学方程式为Na2CO3+HCl═NaCl+NaHCO3),那么在【猜想与假设】中存在第4种猜想的可能,则猜想4:废液中含有的溶质为 (写化学式)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】【2016年山东省滨州市】某化学兴趣小组在实验室做了如图所示的A、B两个实验.

A、B两个实验结束后,小明同学将两支试管中的物质同时加入一洁净的烧杯中(如图C所示).混合后,观察到烧杯中白色沉淀明显增加,同学们将烧杯内的物质过滤,对所得滤液中溶质的成分进行探究.
【分析】A实验结束后,反应物中一定有剩余的是________(填化学式).B实验中发生反应的化学方程式为________.
【猜想】小明猜想:滤液中的溶质是NaCl、Na2CO3;
小滨猜想:滤液中的溶质是NaCl、CaCl2;
小英猜想:滤液中的溶质是NaCl、CaCl2、HCl;
你的猜想:滤液中的溶质是________.
【讨论】你认为________的猜想一定不合理,请说出理由________ .
【实验】若要验证小明的猜想,请完成下表的方案.
实验步骤 | 预想的实验现象 | 实验结论 |
取少量滤液于试管中,滴入_________ | 溶液中有气泡产生 | 小明的猜想正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列实验设计不可行的是( )
A.可用点燃的方法除去CO2中的CO B.可用MnO2区分水和过氧化氢
C.可用紫色石蕊试液区分CO2和O2 D.可用肥皂水区分硬水与软水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】【2016年湖北省宜昌市】学习生活中的化学,解释生活中的现象,化学就在我们身边。
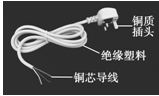
(1)右图是常用的电源插头,在标示的部件中,属于有机合成材料的是 。
(2)铜能制成插头和导线,是利用了金属铜的 性和 性。
(3)厕所用清洁剂(含盐酸)不慎洒到大理石地面上,会发出嘶嘶声。用化学方程式表示原因: 。
(4)我国药学家屠呦呦因研制新型抗疟药青蒿素和双氢青蒿素而获得2015年诺贝尔生理学或医学奖。东晋名医葛洪《肘后备急方》中就有青蒿素抗疟的记载:“青蒿一握,以水二升渍,绞取汁,尽服之”,这里的“水”作_________。上述水煎青蒿治疗疟疾,药性很不稳定,效果很差。屠呦呦改用乙醇提取,控温60℃,药效显著提高,说明青蒿素具有的性质是(答一条):_________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】【2016年湖南省株洲市】为了探究石灰石的纯度(假设样品中的杂质既不溶于水也不与盐酸反应),称取40g石灰石样品等分为4份(分别编号为①、②、③、④),每份样品分别与一定量的稀盐酸反应,所得数据如表所示:
样品编号 | ① | ② | ③ | ④ |
稀盐酸的质量 | 25g | 50g | m(80<m<150) | 150g |
剩余固体的质量 | 7.5g | 5g | 2g | 2g |
然后,为了探究石灰石与稀盐酸反应后所得溶液中的溶质成分,将编号③所得溶液过滤,取滤液质量的![]() 于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关的变化如图所示:
于烧杯中,向其中滴加质量分数为10.6%的碳酸钠溶液使其充分反应直至过量,有关的变化如图所示:

分析题中有关信息和图表,回答下列问题:
(1)该石灰石样品的纯度为 。
(2)编号③所用稀盐酸的质量m为 g。
(3)A点处对应的溶液中溶质的质量分数是多少?(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】【2016年四川省泸州市】海洋是人类千万年来赖以生存的重要资源宝库,图1是海水中化学资源的图示。请结合图示回答相关问题。

(1)取海水滴加AgNO3溶液的现象是 。
(2)下列有关海水及其开发的说法正确的是 。
a.图2中海水所含化学资源都是化合物
b.蒸馏法淡化海水是化学变化
c.海水资源的开发不需要考虑环境保护问题
d.海水中含有NaCl和MgCl2
(3)海水中含有10个电子的微粒有H2O、Mg2+和 。
(4)工业利用海水制取纯碱和轻质MgO的流程图如图3,据图回答下列问题。
①MgO的名称是 。
②海水晒盐的一系列操作X是蒸发、 ;过滤;实验室进行操作Y时需使用玻璃棒,其作用是 。
③氨碱法制取纯碱是先制成饱和氨盐水,再不断通入二氧化碳,反应生成碳酸氢钠和氯化铵,产生析出碳酸氢钠的原因是 ,碳酸氢钠分解生成纯碱的化学方程式是 。
④苦卤(含MgCl2与NaCl)加入纯碱的反应类型是 。
⑤2.4×105t海水中含镁元素的质量是 t,生产中实际得到523.6t气体Z,请计算流程中MgO的产率,写出必要的计算过程。
(已知:产率= ![]() ×100%,“理论上的产物质量”是不考虑损失,且反应物完全反应时的产物质量)
×100%,“理论上的产物质量”是不考虑损失,且反应物完全反应时的产物质量)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】【2016年广西省玉林市、防城港市】工业盐酸中通常溶有少量的FeCl3而呈黄色,小红为测定某工业盐酸中HCl的含量进行如下实验:取某工业盐酸l00g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示,FeCl3与NaOH反应的化学方程式为FeCl3+3NaOH═Fe(OH)3↓+3NaCl.请回答下列问题:

(1)FeCl3与NaOH恰好完全反应时,生成沉淀的质量是 _________g.
(2)该工业盐酸中HCl的质量分数是多少?(写出计算过程)
(3)取l00g该工业盐酸稀释成HCl质量分数为10%的稀盐酸,需加多少克水?(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com