(2012?丹阳市二模)某校兴趣小组中的甲、乙两位同学进行了制取氢氧化铜的实验.
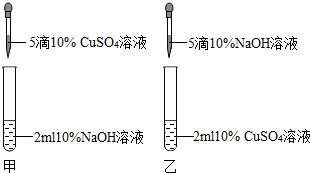
[实验现象]甲同学得到了蓝色沉淀,乙同学得到了浅绿色沉淀.
[实验讨论]甲同学得到的蓝色沉淀一定是氢氧化铜,请写出反应的化学方程式为_
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
2NaOH+CuSO4=Cu(OH)2↓+Na2SO4
.那么乙同学得到的浅绿色沉淀是什么呢?
[查阅资料]氢氧化钠与硫酸铜反应可能会生成碱式硫酸铜,它是浅绿色、受热会分解、不溶于水但能溶于酸的物质,在酸性溶液中可发生反应生成Cu
2+、S0
42-和水.
[拓展探究]甲、乙两位同学对碱式硫酸铜产生了兴趣,分别进行了下列实验.
[实验设计]甲同学:证明该浅绿色沉淀中含有硫酸根
(1)将浅绿色的浊液过滤,并把得到的浅绿色沉淀用蒸馏水多次洗涤;
(2)取最后一次洗涤液,加入
BaCl2
BaCl2
溶液,没有白色沉淀产生,说明沉淀已洗净;
(3)把绿色沉淀转移到试管中,加入足量的
稀盐酸
稀盐酸
溶液使沉淀完全溶解,再加入氯化钡溶液,有大量白色沉淀生成,表示浅绿色沉淀中有S0
42-.
乙同学:探究碱式硫酸铜受热分解的产物--取适量碱式硫酸铜加入试管中充分进行加热,并把生成的气体依次通过B、C、D装置.
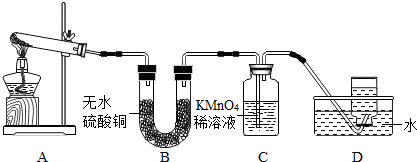
现象与结论:A中残留有黑色固体,取样加入足量的稀硫酸中,溶液变成
蓝色
蓝色
色且无其它明显现象,说明该黑色固体是CuO;
B中无水硫酸铜变成蓝色,说明生成了
水
水
;
C中KMnO
4稀溶液褪色,说明生成了
SO2
SO2
;
等D中集气瓶内气体收满后,正放在桌上,乙同学用
带火星的木条
带火星的木条
证明生成了O
2.
[深入探究]确定此次得到的浅绿色沉淀的组成
[查阅资料](1)碱式硫酸铜其有多种可能的组成,如:Cu
2(OH)
2SO
4、Cu
3(OH)
4SO
4或Cu
4(OH)
6SO
4等.
(2)碱式硫酸铜可表示为:aCu(OH)
2?bCuSO
4.已知Cu(OH)
2的分解温度为66℃∽68℃,生成对应的两种氧化物;而CuSO
4的分解温度为600℃以上.
[实验讨论]同学们用热分析仪对该浅绿色沉淀进行热分解,获得相关数据,绘成固体质量变化与分解温度的关系如图.
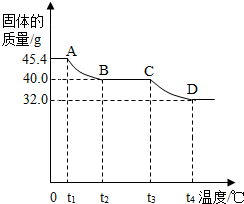
请根据图示回答下列问题:
①0~t
1段内固体质量不变的原因是
没有达到反应所需的温度
没有达到反应所需的温度
.
②A B、C D段固体质量减轻,请写出导致固体质量减轻的生成物的化学式:
AB段:
H2O
H2O
;
CD段:
O2、SO2
O2、SO2
;
③通过计算可得:该碱式硫酸铜的化学式是
Cu4(OH)6SO4
Cu4(OH)6SO4
;
[实验结论](1)乙同学实验中NaOH溶液与CuSO
4溶液反应生成上述碱式硫酸铜的化学方程式为
6NaOH+4CuSO4=Cu4(OH)6SO4↓+3Na2SO4.
6NaOH+4CuSO4=Cu4(OH)6SO4↓+3Na2SO4.
.
(2)当NaOH溶液与CuSO
4溶液反应时,只有控制CuSO
4的量一定,NaOH
过量
过量
(填“过量”或“不足”)时才能生成蓝色沉淀.
(3)当反应物的量不同,产物可能不同,试另举一例:
木炭燃烧,氧气不足时生成CO,氧气充足时生成CO2.
木炭燃烧,氧气不足时生成CO,氧气充足时生成CO2.
.


 阅读快车系列答案
阅读快车系列答案




 在我校实验室实施的扬州市2011年中考化学实验操作考查刚刚落下帷幕.实验考查中H2O2分解制氧气为何不采用MnO2作催化剂?同学们为之展开了探究.
在我校实验室实施的扬州市2011年中考化学实验操作考查刚刚落下帷幕.实验考查中H2O2分解制氧气为何不采用MnO2作催化剂?同学们为之展开了探究.