
【题目】在一次化学实验中,同学们将饱和硫酸铜溶液逐滴加到5mL饱和氢氧化钠溶液中,观察到以下异常实验现象:
实验序号 | 滴加CuSO4溶液的量 | 实验现象 |
① | 第1~6滴 | 有蓝色沉淀,但振荡后沉淀消失,形成亮蓝色溶液 |
② | 第7~9滴 | 产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
在实验①中同学们根据所学初中化学知识判断蓝色沉淀是氢氧化铜,请你写出生成蓝色沉淀的化学方程式 。
实验①中蓝色沉淀为什么消失?同学们继续进行如下探究。
【查阅资料】I.氢氧化铜在温度70℃—80℃时可分解生成氧化铜;
II.四羟基合铜酸钠[Na2Cu(OH)4]溶于水,溶液呈亮蓝色
【猜想与讨论】小陶认为蓝色沉淀消失可能是氢氧化铜发生了分解。其他同学一致否定了他的猜测,理由是 。
同学们交流讨论后,提出以下两种猜想。
猜想一:少许氢氧化铜可溶于足量水中。
猜想二:氢氧化铜可在足量氢氧化钠浓溶液中溶解,溶液呈亮蓝色。
【实验探究】同学们用氢氧化铜粉末(其它试剂可任选)设计如下实验。请填写表中空格。
实验序号 | 实验方法与操作 | 实验现象 | 结论 |
③ | 将少许Cu(OH)2粉末加到5mL蒸馏水中,充分振荡 |
| 猜想一错误 |
④ |
|
| 猜想二正确 |
【结论与反思】(1)根据实验,并进一步查阅资料知道,氢氧化铜在氢氧化钠溶液中溶解生成Na2Cu(OH)4,反应的化学方程式是 。
(2)根据实验可知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,依据的实验现象是 。
(3)写出氢氧化铜受热分解生成黑色固体的化学方程式 。
【答案】CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
【猜想与讨论】如分解则会生成氧化铜是黑色固体,而蓝色沉淀消失后是形成亮蓝色溶液
【实验探究】③沉淀不溶解,液体仍为无色
④将少许Cu(OH)2粉末加入到足量氢氧化钠浓溶液中,充分振荡固体溶解,溶液呈亮蓝色
【结论与反思】(1)2NaOH+Cu(OH)2= Na2Cu(OH)4(2)蓝色沉淀逐渐变为黑色(3)Cu(OH)2 ![]() CuO+H2O
CuO+H2O
【解析】
试题分析:生成蓝色沉淀的化学方程式CuSO4+2NaOH==Cu(OH)2↓+Na2SO4;蓝色沉淀消失可能是氢氧化铜发生了分解,这种猜想是错误的,理由是如分解则会生成氧化铜是黑色固体,而蓝色沉淀消失后是形成亮蓝色溶液;将少许Cu(OH)2粉末加到5mL蒸馏水中,充分振荡,沉淀不溶解,液体仍为无色说明氢氧化铜不能溶于水中,所以猜想一错误;将少许Cu(OH)2粉末加入到足量氢氧化钠浓溶液中,充分振荡固体溶解,溶液呈亮蓝色,说明猜想二正确,氢氧化铜在氢氧化钠溶液中溶解生成Na2Cu(OH)4,反应的化学方程式是2NaOH+Cu(OH)2=Na2Cu(OH)4。根据实验可知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,依据的实验现象是蓝色沉淀逐渐变为黑色,说明氢氧化铜发生了分解反应。氢氧化铜受热分解生成黑色固体的化学方程式Cu(OH)2![]() CuO+H2O。
CuO+H2O。


科目:初中化学 来源: 题型:
【题目】A—H是初中化学常见的化合物,且分别是由H、O、S、Na、Ca、Cu中的两种或三种元素组成的。其中B、E是氧化物,E中两种元素质量之比为2:3;C、F、H为相同类别的化合物,F易溶于水并放出大量的热"G的溶液呈蓝色。图中的“一”表示两端的物质间能发生化学反应;“一”表示物质间存在转化关系;部分反应物、生成物或反应条件已略去。

(1)写出相应物质的化学式G________;H________
(2)写出E与F反应的化学方程式为________________________________
(3)试写出由C—B发生反应的化学方程式________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】溶液是一种重要的混合物。下列有关溶液的说法正确的是( )
A.溶液具有均一性和稳定性,因为溶液中的各种粒子保持静止不动
B.一种物质分散到另一种物质里一定能形成溶液
C.不饱和溶液通过降低温度一定能变成饱和溶液
D.饱和溶液是一定温度下不能再溶解该物质的溶液
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】根据下图回答问题。

(1)实验仪器a的名称是 。
(2)实验室用高锰酸钾制取氧气的化学方程式为 ,所选用的发生装置是 。
(3)实验室制取并收集二氧化碳选用的装置是 ,检验二氧化碳是否收集满的方法是 。
(4)某小组同学利用下图所示装置探究铁丝生锈的条件,其中C、D的分液漏斗中为足量且浓度和体积均相同的稀盐酸。

①步骤一:关闭K2和K3,打开K1,A中产生大量气泡。 为保证后续实验的成功,B中所盛放的溶液是 。对比铁丝表面的变化,能够说明铁丝生锈与水有关的最佳装置是 (填“C”、“D”或“E”,下同),能够说明铁丝生锈的快慢与氧气浓度有关的装置是 。
②步骤二:关闭K1,打开K2和K3,将装置C、D中分液漏斗内的稀盐酸同时全部注入广口瓶中,C瓶中现象是 ;D瓶中溶液变成黄色反应的化学方程式为 ,由此也可以判断铁丝生锈情况。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组根据下图装置进行实验室制取气体的探究。请你参与并回答:
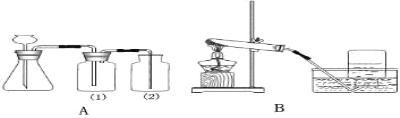
(1)写出仪器的名称:发生装置中盛放药品(产生气体的药品)的仪器A:_____ B: _______
(2)如果用氯酸钾与二氧化锰制取氧气,应选择的发生装置为 ________(填序号),该反应的化学方程式为 ________________________。
(3)实验室制取并收集二氧化碳气体,一般选择装置___________(填序号)。其反应的化学方程式为____________________________________________。若要制取干燥的二氧化碳,(1)中要盛装的药品是_________. (A浓盐酸 B浓硫酸 C氢氧化钠溶液)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com