
【题目】二氧化碳能与过氧化钠(Na2O2,淡黄色固体)在常温下反应产生氧气,并生成碳酸钠,且伴有能量的释放。
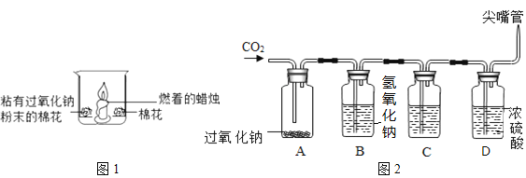
(1)如图1所示,在空气中放置时,两团棉花均不燃烧;若将足量二氧化碳倒入烧杯时,可以观察到的现象有:①______;②粘有过氧化钠的棉花燃烧;③未粘有过氧化钠的棉花不燃烧。通过上述实验的对比分析,写出产生现象②的原因______。
(2)为验证二氧化碳能与过氧化钠在常温下反应产生氧气,设计了图2实验(氢氧化钠溶液能与二氧化碳反应;浓硫酸有吸水性,且既不与二氧化碳反应,也不与氧气反应)。
①B瓶的作用是吸收未反应完的二氧化碳,C瓶的作用是检验二氧化碳是否被B瓶吸收完,则C瓶中盛放的溶液是______(写名称)。
②为验证过氧化钠和二氧化碳反应生成氧气,采用的验证方法是______。
③写出过氧化钠和二氧化碳反应的化学方程式_____。
【答案】)蜡烛的火焰熄灭 过氧化钠与二氧化碳反应生成氧气并放出热量,使棉花与氧气接触,同时温度上升到棉花的着火点 澄清石灰水 用一根带火星的木条放在尖嘴管口,若发现木条复燃,则说明反应生成了氧气 2Na2O2+2CO2=2Na2CO3+O2
【解析】
(1)二氧化碳不支持燃烧,所以将足量二氧化碳倒入烧杯时,蜡烛的火焰熄灭;产生现象②的原因是:过氧化钠与二氧化碳反应生成氧气并放出热量,使棉花与氧气接触,同时温度上升到棉花的着火点;
(2)①C瓶的作用是检验二氧化碳是否被B瓶吸收完,二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,C瓶中盛放的溶液是澄清石灰水;
②氧气具有助燃性,能使带火星的木条复燃,所以为验证过氧化钠和二氧化碳反应生成氧气,采用的验证方法是:用一根带火星的木条放在尖嘴管口,若发现木条复燃,则说明反应生成了氧气;
③过氧化钠和二氧化碳反应生成碳酸钠和氧气,化学方程式为:2Na2O2+2CO2=2Na2CO3+O2。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:初中化学 来源: 题型:
【题目】金属汞(Hg)滴到铝板上,能溶解铝,形成液态合金(铝汞齐),使表层的铝原子浓度变低,从而使铝与氧气反应时无法形成致密氧化膜,内部的铝原子不停地与氧气反应(出现“长毛”现象如图),变化过程的微观模型如图。

(1)铝汞齐属于____(填“单质”、“化合物”和“混合物”)。
(2)写出图9中铝被氧化的化学方程式____。
(3)若在表面清洁的铝板上滴上HgCl2溶液,也会出现“长毛”现象。该现象说明铝的金属活泼性比汞____(填“强”或“弱”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在一密闭容器中,物质X不完全燃烧时可以产生一氧化碳、二氧化碳和水。依据下表数据分析得出的结论中,正确的是
物质 | X | 氧气 | 二氧化碳 | 水 | 一氧化碳 |
反应前质量/g | 6.6 | 8.8 | 0 | 0 | 0 |
反应后质量/g | 2 | 0 | 6.6 | 5.4 | a |
A. X中碳元素的质量分数为52.2% B. X中只含有C、H两种元素
C. 表中a的值为3.4 D. 无法确定X中是否含有氧元素
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】水是生命之源,人类的生产、生活都离不开水。
(1)自然界中的水含有许多可溶性和不溶性杂质。长期饮用硬水可能会引起体内结石,生活中常用____________的方法来降低水的硬度。
(2)水是常用的溶剂,配制下列溶液时,以水做溶剂的是_______(填序号)。
A.生理盐水 B.医用碘酒 C.高锰酸钾溶液 D.医用酒精
(3)下表是NaCl、KNO3在不同温度时的溶解度
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
①根据表中的数据,在坐标纸上绘制出氯化钠和硝酸钾两种物质的溶解度曲线。(请用铅笔在答题卡的坐标纸上绘图)________
②根据绘制的氯化钠和硝酸钾的溶解度曲线判断,温度大约在_____℃时,两种物质的溶解度大小相等。
③现有氯化钠和硝酸钾各40g ,30℃时,分别加入两只盛有100g水的烧杯中,能得到饱和溶液的是______(填溶质名称), 将上述得到的不饱和溶液转化为该温度下的饱和溶液,可采用的方法是_____。
④在60℃时,硝酸钾的溶解度是110g。这句话的含义是______。
(4)以太阳能为热源,经由铁氧化合物循环分解水的过程如右图所示:
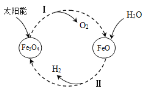
① 写出在一定条件下发生的反应Ⅱ的化学方程式______。
② 在上述循环过程中,最终得到的产品是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室配制100 g 溶质质量分数为5%的氯化钠溶液。实验操作如下:
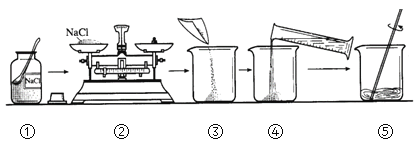
(1)操作④中量筒的量程是_____(填“10 mL”、“50 mL”或“100 mL”)。
(2)若操作③中有部分固体洒落桌面,所得溶液的溶质质量分数会_____(填“偏大”、“不变”或“偏小”)。
(3)配制好的溶液要装在试剂瓶中,并贴好标签。请在如图的标签中填上相应的内容。
 _____
_____
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】法国化学家拉瓦锡曾做过如图实验。下列叙述正确的是( )
①汞槽中的汞起到液封的作用
②实验时装置内物质的总质量保持不变
③该实验可用于测定空气中氧气的含量
④若实验中金属加热后质量增加则表明实验失败
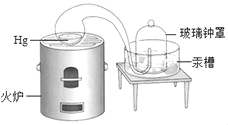
A. ①②③ B. ①②④ C. ①③④ D. ②③④
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】还原铁粉是结构疏松的单质铁,是重要的工业原料。
I.物质制备。还原铁粉的某种制备工艺流程如下:
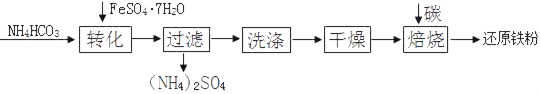
(1)“转化”时温度需控制在35℃以下,防止受热分解的物质是_____。
(2)“干燥”过程中有少量的FeCO3转化为FeOOH和CO2,此时与FeCO3反应的物质有_____(填化学式)
(3)FeCO3和 FeOOH在空气中焙烧转化为Fe2O3,FeOOH转化为Fe2O3的反应类型是_____。写出Fe2O3在高温条件下与碳(C)反应生成Fe和CO2的化学方程式:_____。
Ⅱ.成分研究。“暖宝宝”一般由还原铁粉、活性炭和氯化钠等组成。
(实验目的)测定未开启的“暖宝宝”中铁的质量分数。
(实验过程)如图五所示,甲同学称得反应前总质量为85g,打开活塞待稀盐酸全部滴入后立即关闭活塞。锥形瓶内的现象有:固体逐渐减少,_____。反应完毕后测得锥形瓶和反应后混合物的总质量为84.8g。
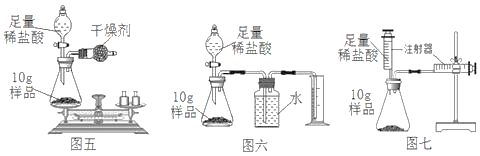
(评价反思)
(1)乙同学认为甲同学方案误差较大,于是设计如图六的方案。甲同学方案误差较大的原因是_____。
(2)丙同学认为乙同学方案即使操作无失误,测量结果仍会偏大,原因是_____。
(3)丙同学设计了图七的实验装置。利用该装置实验时,在气密性良好的前提下,如果往锥形瓶中注入的稀盐酸体积为V1mL,等充分反应并且待装置冷却后,观察右侧注射器读数増加V2mL.实验条件下氢气密度为 d g/mL.则样品中铁的质量分数为_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】小敏研究影响锌与盐酸反应快慢的因素。
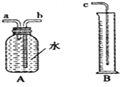
序号 | 盐酸溶液浓度 | 2分钟内产生氢气的体积 |
1 | 5% | 10mL |
2 | 15% | 28mL |
(1)写出该反应的化学方程式。
(2)图中A、B仪器可以组装一套测量气体体积的装置,利用该装置时A中的_____(a或b)管接c。
(3)他选用2克完全相同的锌片分别和同体积5%、15%的稀盐酸进行实验。获得表格数据。由此推断实验是通过_________来体现反应快慢的。
(4)小敏分析数据得到如下结论:锌与盐酸反应快慢与盐酸浓度有关,盐酸浓度越大反应越快。其他同学认为结论不可靠,他们的依据是:______________。
(5)实验中小敏发现锌与盐酸反应时,一开始产生氢气速度并没有随盐酸浓度的减少而减慢,查阅资料得知化学反应中往往伴随着能量变化。由此作出猜想:锌与盐酸反应快慢还与_______有关。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】将两份m1g的镁条和足量氧气分别置于密闭装置和开放装置中充分反应,实验过程中固体的质量(m) 随加热时间(t)变化如图所示。下列有关分析错误的是
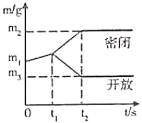
A. 0<t<t1时,有氧化镁生成
B. m1与m2质量之差等于反应被消耗的氧气质量
C. m3< m2是因为散逸的白烟中含氧化镁小颗粒
D. m1与m3质量之差等于散逸走的氧化镁的质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com