
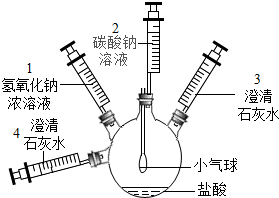
 某实验小组设计了如图实验装置及方案,实验步骤如下,请回答有关问题:
某实验小组设计了如图实验装置及方案,实验步骤如下,请回答有关问题:| 实验操作 | 实验现象 | 实验结论 |
| 取少量瓶内溶液于试管中,加入碳酸钠溶液,振荡 | 有白色沉淀生成 | 瓶内溶液中溶质的成分含有氢氧化钙 |
分析 第一步:根据盐酸会与碳酸钠反应,使瓶内气压增大进行分析;
第二步:根据二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水进行分析;
第四步:根据二氧化碳会与氢氧化钙反应生成白色的碳酸钙沉淀进行分析;
第五步:根据碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠进行分析;
第六步:①提出猜想:根据瓶中发生的化学反应判断溶质的组成;
②实验验证:根据碳酸钠和氢氧化钙反应会生成碳酸钙沉淀和氢氧化钠进行分析;
实验报告:本实验主要验证二氧化碳能与氢氧化钠发生反应.
解答 解:第一步:盐酸会与碳酸钠反应,使瓶内气压增大,所以实验现象是小气球慢慢变瘪;
第二步:二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为:CO2+Ca(OH)2═CaCO3↓+H2O;
第四步:二氧化碳会与氢氧化钙反应生成白色的碳酸钙沉淀,所以要证明瓶内气体被吸收完全的操作方法和判断依据是:将注射器4稍稍向外拉,若澄清石灰水无明显现象,则证明瓶内气体被吸收完全;
第五步:碳酸钠和氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
第六步:①瓶中所发生反应的化学方程式为:Na2CO3+2HCl═2NaCl+H2O+CO2↑,Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,由此可知溶质一定有氯化钠和氢氧化钠,由步骤①中不再产生气泡可知,盐酸不会有剩余,碳酸钠或氢氧化钙可能有剩余,溶液的溶质中一定含有NaOH和NaCl,可能含有氢氧化钙或Na2CO3;
实验验证:碳酸钠和氢氧化钙反应会生成碳酸钙沉淀和氢氧化钠,所以
| 实验操作 | 实验现象 | 实验结论 |
| 取少量瓶内溶液于试管中,加入碳酸钠溶液,振荡 | 有白色沉淀生成 | 瓶内溶液中溶质的成分含有氢氧化钙 |
| 实验操作 | 实验现象 | 实验结论 |
| 取少量瓶内溶液于试管中,加入碳酸钠溶液,振荡 | 有白色沉淀生成 |
点评 解答本题关键是要知道氢氧化钠与二氧化碳反应后,使瓶内压强减小,熟悉方程式的书写方法.


 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案科目:初中化学 来源: 题型:填空题
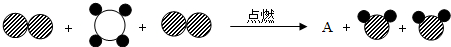
 ”表示碳原子,“
”表示碳原子,“ ”表示氢原子,“
”表示氢原子,“ ”表示氧原子,该生成物A为
”表示氧原子,该生成物A为查看答案和解析>>
科目:初中化学 来源: 题型:解答题
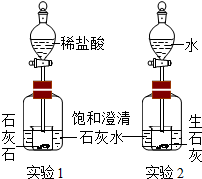 如图,实验一和实验二都会观察到的现象是澄清的石灰水变浑浊.实验一产生这一现象的原因是石灰石和稀盐酸反应生成了二氧化碳,二氧化碳与石灰水中的氢氧化钙反应生成了不溶于水的碳酸钙.实验二产生这一现象的原因是生石灰和水反应放出大量的热使石灰水的温度上升,石灰水中的氢氧化钙的溶解度随着温度的升高而减小,有Ca(OH)2固体析出.
如图,实验一和实验二都会观察到的现象是澄清的石灰水变浑浊.实验一产生这一现象的原因是石灰石和稀盐酸反应生成了二氧化碳,二氧化碳与石灰水中的氢氧化钙反应生成了不溶于水的碳酸钙.实验二产生这一现象的原因是生石灰和水反应放出大量的热使石灰水的温度上升,石灰水中的氢氧化钙的溶解度随着温度的升高而减小,有Ca(OH)2固体析出.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 溶于水,溶液温度升高的物质:NaOH、浓H2SO4、NH4NO3 | |
| B. | 地壳中几种元素含量的比较:O>Si>Al | |
| C. | 构成物质的几种粒子:分子、原子、离子 | |
| D. | 常见的碱:NaOH、KOH、Ca(OH)2 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 实验结论 | |
| 甲 | 取少量样品于试管中,滴入几滴无色酚酞溶液 | 溶液由无色变红色 | 猜想二正确 |
| 乙 | 取少量样品于试管中,加入硫酸铜溶液(或通入二氧化碳) | 有蓝色沉淀产生(或产生白色沉淀) |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H2SO4、KOH、NaCl | B. | KNO3、NaCl、CuSO4 | ||
| C. | AgNO3、NaCl、HCl | D. | H2SO4、Na2SO4、KNO3 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
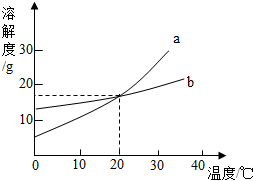 如图是a、b两种固体物质的溶解度曲线.
如图是a、b两种固体物质的溶解度曲线.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
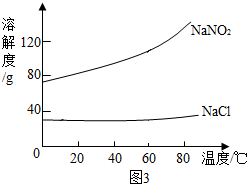
| 物质名称 | 水溶性 | 熔点 | 溶液的酸碱性 | 热稳定性 | 与稀盐酸作用 |
| 亚硝酸钠 | 易溶,在15℃时 溶解度为81.5g | 271℃ | 弱碱性 | 320℃以上会分解 放出刺激性气体 | 放出红棕色气体 |
| 氯化钠 | 易溶,在15℃时 溶解度为35.8g | 801℃ | 中性 | 受热不分解 | 不反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com