
分析 首先根据反应原理找出反应物、生成物、反应条件,根据化学方程式的书写方法、步骤(写、配、注、等)进行书写即可.
解答 解:(1)镁燃烧生成氧化镁,加持镁条的仪器是坩埚钳,故填:2Mg+O2$\frac{\underline{\;点燃\;}}{\;}$2MgO;坩埚钳;
(2)过氧化氢溶液与二氧化锰混合生成水和氧气,设过氧化氢溶液的质量为100,故6%的过氧化氢溶液中氢元素的质量分数为:$\frac{100g×6%×\frac{1×2}{34}+(100g-100g×6%)×\frac{1×2}{18}}{100g}$×100%≈10.8%,故填:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;10.8%;
(3)氨水与硫酸反应生成硫酸铵和水,生成的硫酸铵能作氮肥使用,故填:2NH3•H2O+H2SO4═(NH4)2SO4+2H2O;氮;
(4)一氧化碳与氧化铁高温反应生成铁和二氧化碳,一氧化碳和二氧化碳的化学计量数之比为1:1,故填:Fe2O3+3CO$\frac{\underline{\;高温\;}}{\;}$2Fe+3CO2;1:1;
(5)硝酸铵受到撞击会迅速分解生成一氧化二氮气体和水,一氧化二氮中氮元素的化合价为+1,故填:NH4NO3$\frac{\underline{\;撞击\;}}{\;}$N2O+2H2O;+1.
点评 本题难度不大,考查学生根据反应原理书写化学方程式的能力,化学方程式书写经常出现的错误有不符合客观事实、不遵守质量守恒定律、不写条件、不标符号等.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:初中化学 来源: 题型:解答题
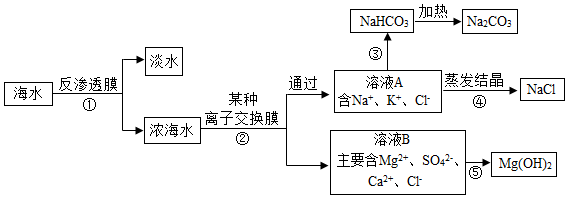
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 0.30g | B. | 0.20g | C. | 0.15g | D. | 0.45g |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
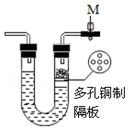 如图所示装置中的现象是实验过程中呈现的实验现象,请回答相关问题.
如图所示装置中的现象是实验过程中呈现的实验现象,请回答相关问题.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
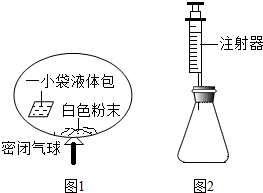
| 实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
| 名称 | 质量/g | ||
| ① | 碳酸氢钠 | 0、10 | V1 |
| ② | 碳酸钠 | 0、10 | V2 |
| ③ | 白色粉末 | x | V1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com