
| A. | 羊毛 | B. | 水泥 | C. | 合金 | D. | 塑料 |
科目:初中化学 来源: 题型:选择题
| A. | 2g氢气与18g氧气反应,根据质量守恒推出生成的水的质量为20g | |
| B. | 丙烷燃烧生成二氧化碳和水,根据元素守恒推出丙烷由碳、氢、氧元素组成 | |
| C. | 100mL36%的浓盐酸用300 mL水稀释,根据溶质守恒推出稀盐酸的溶质质量分数为9% | |
| D. | 相同分子数的CO和O2混合,在一定条件下充分反应,根据原子守恒推出反应后气体中C、O原子数比为1:3 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
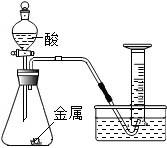 某化学兴趣小组探究“影响金属与酸反应速率的因素”,请你参与并回答问题:
某化学兴趣小组探究“影响金属与酸反应速率的因素”,请你参与并回答问题:| 实验编号 | 选用金属 (均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 0~1min | 1~2min | 2~3min | 3~4min | 4~5min | 前5min共收集气体 | |||
| Ⅰ | 锌片 | 10% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 47.6 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
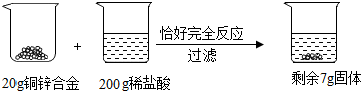
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
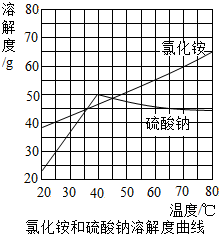 如图为氯化铵和硫酸钠的溶解度曲线,下列说法正确的是( )
如图为氯化铵和硫酸钠的溶解度曲线,下列说法正确的是( )| A. | 将50℃时硫酸钠饱和溶液降温,始终有晶体析出 | |
| B. | 40℃时,将30g的硫酸钠加入到50g的水中充分溶解,所得溶液中硫酸钠的质量分数是37.5% | |
| C. | 除去硫酸钠中少量的氯化铵,较好的物理方法是将制成的40℃时的饱和溶液,降温结晶、过滤 | |
| D. | 某化工厂以氯化钠和硫酸铵为原料制备氯化铵及副产品硫酸钠,发生的是复分解反应,设计生产方案时不需要考虑物质的溶解度 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
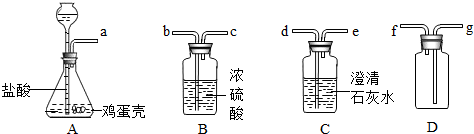
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Al2O3 | B. | Fe | C. | Fe2O3 | D. | Al |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
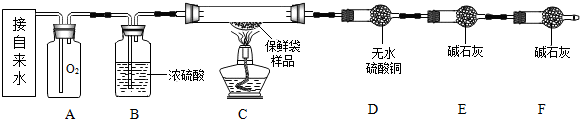
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com