
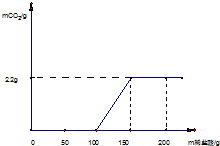
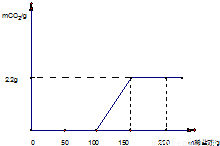
 为测定某变质烧碱样品中NaOH的质量分数,取一定量的该烧碱样品于试管中,向样品中逐滴加入过量的稀盐酸,产生的气体与所加入稀盐酸质量关系如下图所示:
为测定某变质烧碱样品中NaOH的质量分数,取一定量的该烧碱样品于试管中,向样品中逐滴加入过量的稀盐酸,产生的气体与所加入稀盐酸质量关系如下图所示: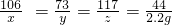
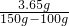 ×100%=7.3%;
×100%=7.3%;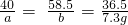 、
、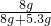 ×100%=60.2%;
×100%=60.2%;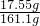 ×100%=10.9%.
×100%=10.9%.

科目:初中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
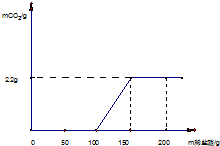 (2009?平谷区一模)为测定某变质烧碱样品中NaOH的质量分数,取一定量的该烧碱样品于试管中,向样品中逐滴加入过量的稀盐酸,产生的气体与所加入稀盐酸质量关系如下图所示:
(2009?平谷区一模)为测定某变质烧碱样品中NaOH的质量分数,取一定量的该烧碱样品于试管中,向样品中逐滴加入过量的稀盐酸,产生的气体与所加入稀盐酸质量关系如下图所示:查看答案和解析>>
科目:初中化学 来源:2009年北京市平谷区中考化学一模试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com