
| 溶解度 |
| 溶解度+100g |
| 40g |
| 140g |


科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:
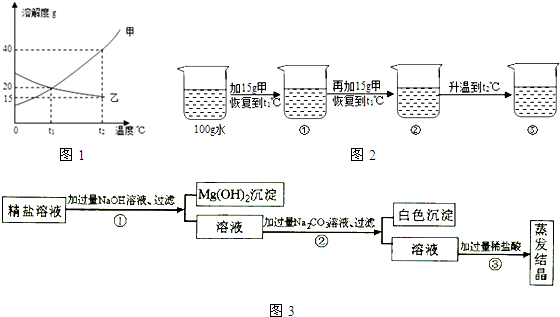
Ⅰ. 如图1为甲、乙(均不含结晶水)两种固体物质的溶解度曲线.
〔1〕溶解度随温度升高而增大的物质是 (填“甲”或“乙”),t1℃时,甲的溶解度
(填 “大于”“小于” 或“等于”)乙的溶解度;
或“等于”)乙的溶解度;
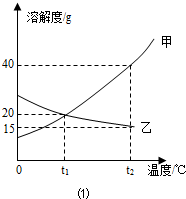
〔2〕某同学在t1℃时开始进行如图2实验,得到相应的溶液①~③.
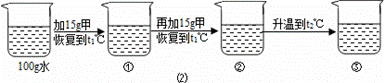
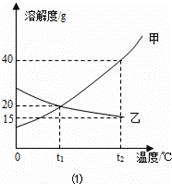
在溶液①~③中属于饱和溶液的是 (填序号)、溶质质量分数最大的是 (填序号);
(3)在溶液③中再加入25g甲后,充分搅拌,恢复到t2℃时,所得溶液中溶质的质量分数
为 〔精确到0.1%〕.
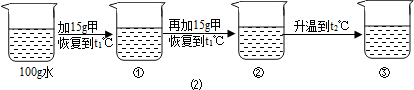
Ⅱ. 某粗盐提纯后得 到的“精盐”中还含有少量
到的“精盐”中还含有少量 可溶性杂质CaCl2、MgCl2。小青同学设计了以下实验方案来除去可溶性杂质。
可溶性杂质CaCl2、MgCl2。小青同学设计了以下实验方案来除去可溶性杂质。
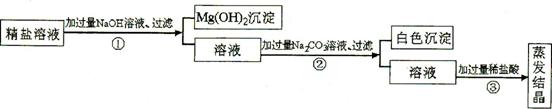
(1)步骤①的化学方程式为 。
(2)步骤②中得到的白色沉淀是 (填化学式)。
(3)步骤③中加稀盐酸是为了除去溶液中的 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com