
分析 (1)复合肥是在氮磷钾三种元素中含有两种或者两种以上的化合物;
(2)根据相关物质的定义和中和反应的本质进行分析;
(3)信息型方程式的书写主要抓紧题目给出的信息进行书写;
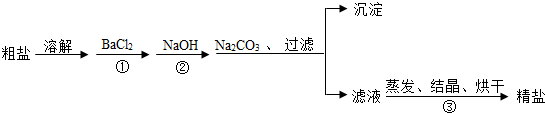
(4)由于实际生产中用于沉淀的实际均过量,这样才能实现除杂的彻底,所以后续实验操作中要除去过量的物质;
(5)根据给出的氢氧化钙的质量和对应的化学方程式求算二氧化碳的质量.
解答 解:
(1)复合肥是在氮磷钾三种元素中含有两种或者两种以上的化合物,常见的复合肥有硝酸钾、磷酸铵等,要求书写化学式.
(2)
A.酸是电离出的阳离子全部为氢离子的化合物,而碱是电离出的阴离子全部为氢氧根离子的化合物,所以酸和碱一定含有氢元素,正确.
B.有盐和水生成的反应不一定是中和反应,如金属氧化物和酸反应生成盐和水,非金属氧化物和碱也生成盐和水,但都不是中和反应.正确.
C.由于氢氧化钠溶解于水导致溶液温度升高,而硝酸铵溶解于水导致溶液温度降低,所以可用水鉴别氢氧化钠固体和硝酸铵固体.正确.
D.用湿润的pH试纸测定溶液的酸碱度,如果测定的是中性溶液,则pH不受影响;测定的是酸性溶液时,测定结果偏大;测定碱性溶液时,测定结果偏小.错误.
故选:D.
(3)题目提示“金属钠露置在空气中与氧气反应,生成氧化钠;钠在空气中燃烧,生成过氧化钠(Na2O2);过氧化钠与水反应生成烧碱和氧气“.所以对应的化学方程式为:2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O22Na2O2+2H2O=4NaOH+O2↑.
(4)由于实际生产或者生活中用于沉淀的实际均过量,这样才能是除杂彻底,所以过程中要除去过量的物质.
(一)进行步骤①后,如何判断BaCl2是否过量,实际上是确定是否硫酸镁有剩余,所以应该取样继续加入氯化钡溶液,具体操作为:取少量上层清液,继续滴加BaCl2溶液,如没有白色沉淀出现,则说明BaCl2过量
(二)由于溶液中有氯化钙和过量的氯化钡,所以要加入Na2CO3溶液除去,所以加入碳酸钠的目的是除去Ca2+、Ba2+.(或除去CaCl2杂质和过量的BaCl2)
(三)由于此时还有过量的氢氧化钠和碳酸钠存在,所以需要继续除去,所以应该在滤液中加入适量的稀盐酸.具体的操作步骤:在滤液中加入适量的稀盐酸以除去氢氧化钠和碳酸钠
(5)设吸收二氧化碳的质量为x
Ca(OH)2+CO2=CaCO3↓+H2O
74 44
2.96g x
$\frac{74}{44}$=$\frac{2.96g}{x}$
解得x=1.76g
答:吸收二氧化碳的质量为1.76g.
故答案为:
(1)KNO3(合理即可);
(2)D;
(3)2Na+O2$\frac{\underline{\;点燃\;}}{\;}$Na2O2; 2Na2O2+2H2O=4NaOH+O2↑;
(4)(一)取少量上层清液,继续滴加BaCl2溶液,如没有白色沉淀出现,则说明BaCl2过量.
(二)除去Ca2+、Ba2+.(或除去CaCl2杂质和过量的BaCl2).
(三)在滤液中加入适量的稀盐酸以除去氢氧化钠和碳酸钠.
(5)1.76g.
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:初中化学 来源: 题型:选择题
| A. | “氧气的制取与性质”实验中,做细铁丝燃烧实验时要在集气瓶底预留一点水 | |
| B. | “酸与碱的化学性质”实验中,将实验废液直接倒入下水道 | |
| C. | “溶液的酸碱度”实验中,将pH试纸伸入溶液中测定酸碱度 | |
| D. | “粗盐的初步提纯”实验中,持续加热食盐溶液直至水分蒸干 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 除去杂质的方法 |
| A | N2 | O2 | 通过灼热的铜网 |
| B | KCl | MnO2 | 加水充分溶解,过滤,蒸发结晶 |
| C | FeSO4溶液 | CuSO4 | 加入足量锌粉,充分反应,过滤 |
| D | NaCl溶液 | CaCl2 | 滴加碳酸钠溶液至恰好完全反应,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
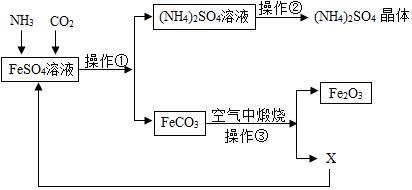
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
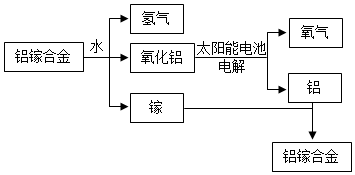 美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示).下列有关该工艺的说法错误的是( )
美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(如图所示).下列有关该工艺的说法错误的是( )| A. | 铝镓合金可以循环使用 | |
| B. | 该流程把太阳能转化为氢能 | |
| C. | 该工艺实质上把水转化为氢气和氧气 | |
| D. | 铝镓合金与水反应的化学方程式为:Al+3H2O$\frac{\underline{\;一定条件\;}}{\;}$Al2O3+3H2↑ |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
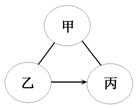 碳酸钠溶液、氢氧化钠溶液和稀盐酸之间的变化关系如图所示.(“-”表示相连的两种物质能发生反应,“→”表示某种物质可转化为另一种物质),回答下列问题:
碳酸钠溶液、氢氧化钠溶液和稀盐酸之间的变化关系如图所示.(“-”表示相连的两种物质能发生反应,“→”表示某种物质可转化为另一种物质),回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
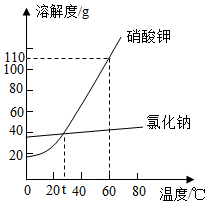 如图,是硝酸钾和氯化钠的溶解度曲线,据图判断下列说法正确的是( )
如图,是硝酸钾和氯化钠的溶解度曲线,据图判断下列说法正确的是( )| A. | 硝酸钾的溶解度大于氯化钠的溶解度 | |
| B. | 60℃时,硝酸钾和氯化钠的饱和溶液各100g,分别降温到t℃时,两种溶液析出的晶体质量相等 | |
| C. | 使氯化钠从其溶液中结晶的最好方法是蒸发溶剂 | |
| D. | 60℃时,饱和硝酸钾溶液的溶质质量分数是110% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com