
分析 (1)根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.因此完全反应后,物质减少的质量就是生成的气体质量;
(2)根据过氧化氢分解的化学方程式和(1)中计算出的氧气的质量,就可计算出参与反应的过氧化氢的质量,根据质量分数公式计算即可.
解答 解:(1)根据质量守恒定律,反应生成氧气的质量=68g+1g-67.4g=1.6g;
(2)设68g过氧化氢溶液中含有过氧化氢的质量为x.
2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑
68 32
x 1.6g
$\frac{68}{32}=\frac{x}{1.6g}$ 解得:x=3.4g
即:过氧化氢溶液中溶质的质量为3.4g
过氧化氢溶液的溶质的质量分数=$\frac{3.4g}{68g}×100%$=5.0%
答:(1)反应生成的氧气的质量是1.6g;
(2)过氧化氢溶液的溶质质量分数为5.0%
点评 本题主要考查学生根据质量守恒定律;运用化学方程式和质量分数公式进行计算的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
 在用稀盐酸和氢氧化钠溶液研究中和反应实验时,某化学兴趣小组的同学认真观察、详实记录,并利用“pH计”测定并绘制了溶液的酸碱度变化如图所示.请完成下列问题:
在用稀盐酸和氢氧化钠溶液研究中和反应实验时,某化学兴趣小组的同学认真观察、详实记录,并利用“pH计”测定并绘制了溶液的酸碱度变化如图所示.请完成下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 它是一种化合物 | B. | 它是-种单质 | ||
| C. | 它是由原子构成的 | D. | 它的相对分子质量是70g |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
| A. | 30℃时,在100 g水里溶解45.8g KNO3时,溶液恰好达到饱和状态 | |
| B. | KNO3的溶解度大于NaCl的溶解度 | |
| C. | NaCl和KNO3的溶解度都随着温度的升高而增大 | |
| D. | NaCl 和KNO3溶解度相等时,温度t的范围在20℃~30℃之间 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
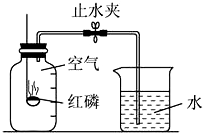 某同学设计了测定空气中氧气含量的实验,实验装置如图.
某同学设计了测定空气中氧气含量的实验,实验装置如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com