某化学兴趣小组的学生研究过量的炭粉与Fe
2O
3在高温条件下反应的气体产物成分.探究过程如下:
(1)提出假设:气体产物全部是C0
2.
(2)查阅资料:a.氮气不能与炭粉及Fe
2O
3反应b.高温下可以发生下列反应:2Fe
20
3+3C
4Fe+3CO
2↑ C+C0
22CO
(3)设计方案:将一定量氧化铁在隔绝空气的环境下与过量炭粉充分反应.用实验中实际测得产生气体的质量,与理论计算得到的CO
2的质量进行比较.
(4)实验装置:如图所示.
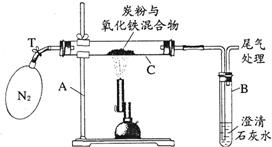
(5)实验操作:
①称量:反应前Fe
2O
3的质量3.20g;炭粉的质量2.00g;玻璃管C的质量48.48g.反应后玻璃管与残留固体共52.24g.
②加热前先通一段时间氮气,再夹紧弹簧夹T,点燃酒精喷灯加热.
(6)问题分析:
①用酒精喷灯而不用酒精灯的目的是
.②加热前先通一段时间氮气的目的是
.
③理论计算:若氧化铁与炭粉反应的气体产物全部是C0
2,求3.20g氧化铁完全反应时生成CO
2的质量.
④根据实验数据计算实验中实际获得气体的质量.
(7)结论:(要求简述获得结论的理由)

 名校课堂系列答案
名校课堂系列答案