
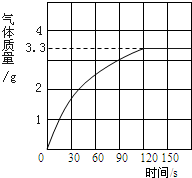
 (1)某化学兴趣小组的同学为了体验“工业冶炼金属”的过程.在实验室做了CO还原CuO的实验,他们称得装有CuO粉末的试管重102g,反应完全后,恢复到室温称量,试管和固体残留物共重100.4g,并收集到CO2 4.4g,请你和他们一起计算:
(1)某化学兴趣小组的同学为了体验“工业冶炼金属”的过程.在实验室做了CO还原CuO的实验,他们称得装有CuO粉末的试管重102g,反应完全后,恢复到室温称量,试管和固体残留物共重100.4g,并收集到CO2 4.4g,请你和他们一起计算: Cu+CO2 △m
Cu+CO2 △m ═
═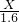
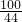 ═
═
 ×100%═60%.
×100%═60%. =22.1cm3.
=22.1cm3.

 智慧小复习系列答案
智慧小复习系列答案科目:初中化学 来源: 题型:
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
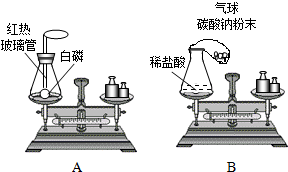
 23、请你结合下列装置图回答问题:
23、请你结合下列装置图回答问题:| 实验操作 | 实验现象 | 实验结论 |
| 实验Ⅰ:把一小片pH试纸放在一块干净的玻璃片上,用 玻璃棒 蘸取沉淀溶解成澄清的溶液沾在试纸上,把试纸呈现的颜色与标准比色卡对照. |
测得被测液的pH=8 | 猜想① 不成立 .(填“成立”或“不成立”) |
| 实验Ⅱ:取沉淀溶解成澄清的溶液于另一支试管中,加入 稀盐酸(硫酸) . |
有气体产生 | 反应的化学方程式为: Ca(HCO3)2+2HCl=CaCl2+2H2O+2CO2↑ .猜想②成立. |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实验步骤 | 观察到的实验现象 |
| ①在试管中加入少量硝酸银溶液,插入 铜丝 ,充分反应. |
溶液逐渐变蓝色; ;铜丝表面附着一层黑色(或灰黑色)物质 . |
| ②在①所得的溶液中,插入 铁丝 ,充分反应. |
溶液逐渐变成浅绿色 ;铁丝表面附着一层红色物质 . |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com