
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:初中化学 来源: 题型:阅读理解
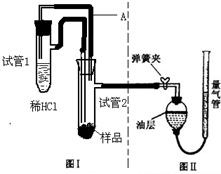 轻质碳酸镁(化学式为4MgCO3?Mg(OH)2?4H2O)是制取氧化镁、颜料、油漆、日用化妆品的工业原料.
轻质碳酸镁(化学式为4MgCO3?Mg(OH)2?4H2O)是制取氧化镁、颜料、油漆、日用化妆品的工业原料.
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验序号 | 实验操作 | 实验现象 | 解释及结论 | ||||||||
| 实验I | 用砂纸擦去镁条表面氧化膜,将其放入盛有适量饱和碳酸氢钠溶液的试管中 | 迅速反应,产生大量气泡和白色不溶物 | 镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物 镁与饱和碳酸氢钠溶液反应能生成一种无色气体和一种白色不溶物 | ||||||||
| 实验Ⅱ | 将实验I中收集到的气体点燃,并在火焰上方罩一干、冷的小烧杯 | 气体安静燃烧、产生淡蓝色火焰, 烧杯内壁有无色小液滴生成 烧杯内壁有无色小液滴生成 . |
该气体燃烧的化学方程式为 2H2+O2
2H2+O2 .
|
| 阳离子﹨阴离子 | OH- | CO32- |
| Na+ | 溶 | 溶 |
| Mg2+ | 不 | 微 |
| 实验序号 | 实验操作 | 实验现象 | 解释及结论 |
| 实验Ⅲ | 称取22.6g实验Ⅰ中所得的白色不溶物,加入足量 稀盐酸(或稀硫酸) 稀盐酸(或稀硫酸) . |
固体溶解,产生无色气泡 | 白色不溶物中 含有 碳酸镁 碳酸镁 . |
将产生气体全部通入装置A和B中(如图所示). |
实验后装置B增重8.8g | 白色不溶物的 成分及质量分 别为 氢氧化镁5.8g、碳酸镁16.8g 氢氧化镁5.8g、碳酸镁16.8g . |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
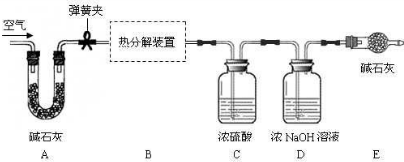
| 装置C的质量(/g) | 装置D的质量(/g) | |
| 实验前 | 232.4 | 208.2 |
| 实验后 | 236.9 | 217.0 |
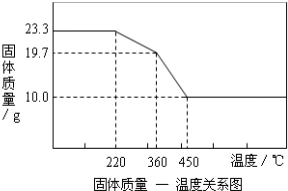
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
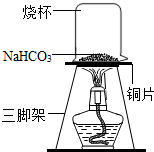 碳酸氢钠(NaHCO3 )俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.
碳酸氢钠(NaHCO3 )俗称小苏打,常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的性质进行探究.| 实验操作 | 预期实验现象 | 得出理论 |
| A将该固体溶于水配置成溶液,取出少量液体,往里面加入足量稀盐酸 | 无明显现象 | 假设 ② ② (填序号)不成立 |
| B另取出少量溶液,往里面加入足量 氯化钙 氯化钙 溶液. |
有白色沉淀产生 有白色沉淀产生 |
固体产物中有Na2CO3. |
| C取操作B静置后所的上层清液,滴入少量酚酞试液. | 无明显现象 | 固体产物中不含有氢氧化钠 固体产物中不含有氢氧化钠 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com