
| A. | 20% | B. | 43% | C. | 40% | D. | 46% |
分析 碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠,碳酸钠和硫酸钠中的钠元素被钡元素代替,再根据提供的数据可以计算原固体混合物中钠元素的质量分数.
解答 解:设钠元素的质量为x,
氯化钡和碳酸钠、硫酸钠反应的化学方程式及其相关方面的质量为:
BaCl2+Na2CO3═BaCO3↓+2NaCl,固体质量增加
106 197 197-106=91
BaCl2+Na2SO4═BaSO4↓+2NaCl,固体质量增加
142 233 233-142=91
可见于前后固体物质而言就是由钠元素换成了钡元素而导致质量的变化.,
即
2Na+----------Ba2+ 固体质量增加
46 137 137-46=91
x 41.2g-23g=18.2g
$\frac{46}{91}$=$\frac{x}{18.2g}$
x=9.2g,
则原固体混合物中钠元素的质量分数为:$\frac{9.2g}{23g}$×100%=40%,
答案:C.
点评 碳酸钠、硫酸钠中的钠元素都转化到反应生成的氯化钠中,这是解答的关键,要注意理解.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:初中化学 来源: 题型:解答题
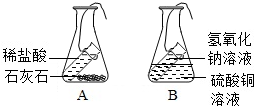 物质发生化学变化的前后,总质量是否发生改变呢?是增加、减少还是不变?小刘、小李按下面的步骤进行探究:
物质发生化学变化的前后,总质量是否发生改变呢?是增加、减少还是不变?小刘、小李按下面的步骤进行探究:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
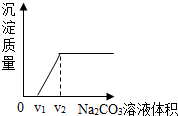
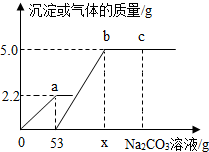 向实验室制取CO2后的废液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液,反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示:
向实验室制取CO2后的废液中逐滴加入溶质质量分数为10.0%的Na2CO3溶液,反应过程中加入的Na2CO3溶液的质量与产生沉淀或气体的质量关系如图所示:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 方案 | (1) | (2) | (3) |
| 实验操作 | 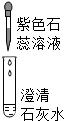 | 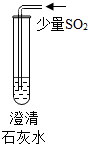 |  |
| 现象 | 溶液变为蓝色 | 澄清石灰水变浑浊 | 红色褪为无色 |
| 结论或解释 | 氢氧化钙溶液能使石蕊等酸碱指示剂变色 | 氢氧化钙溶液能与某些非金属氧化物反应生成盐和水.二氧化硫与澄清石灰水反应的化学方程式是 SO2+Ca(OH)2═CaSO3↓+H2O | 氢氧化钙溶液能与酸发生中和反应 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 | 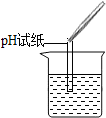 | 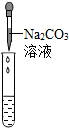 |  |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com