
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:初中化学 来源: 题型:阅读理解
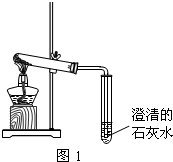 含钠元素、钙元素的化合物是初中化学的重要研究对象之一.
含钠元素、钙元素的化合物是初中化学的重要研究对象之一.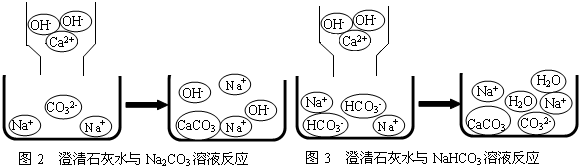
| 实验内容 | 实验现象 | 实验结论 |
| 方案一:取少量滤液加入试 管中,向其中 |
娇娇同学的猜想是正确的. 滤液中含有的两种溶质是 | |
| 方案二:取少量滤液加入试管中,向其中 |
 学们认为实验过程中产生的废液必须处理后再排放.请你对B试管中滤液的处理提出可行的建议
学们认为实验过程中产生的废液必须处理后再排放.请你对B试管中滤液的处理提出可行的建议查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| 实验方案 | 甲 | 乙 | 丙 |
实验操作 |
 |
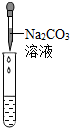 |
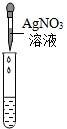 |
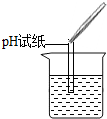
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 有气泡产生 |
产生白色沉淀 |
| 实验结论 | 溶液中有HCl | 溶液中有HCl | 溶液中有HCl |
查看答案和解析>>
科目:初中化学 来源:长宁区二模 题型:问答题
| 实验方案 | 甲 | 乙 | 丙 |
实验操作 |
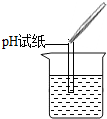 |
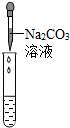 |
 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | ______ |
产生白色沉淀 |
| 实验结论 | 溶液中有HCl | 溶液中有HCl | 溶液中有HCl |
查看答案和解析>>
科目:初中化学 来源: 题型:
为探究“酸碱中和反应”,进行了如下研究。
【实验原理】将稀HCl滴入盛有NaOH溶液的烧杯中,反应的化学方程式为 ;
【提出问题】实验中未观察到明显现象,同学们对该反应是否发生提出了疑问:反应后溶液中溶质是什么?
【假设猜想】溶液中的溶质有氯化钠,还可能有:
猜想1:HCl
猜想2:NaOH
猜想3:HCl和NaOH
你认为上述猜想不合理的是 。
【实验方案】(1)某同学用一支洁净试管取少量烧杯中的溶液,滴加FeCl3溶液,无明显现象,说明烧杯中溶液里一定不含 ;
(2)为了验证其余猜想,各小组进行如下三个方案的探究。
| 实验方案 | 甲 | 乙 | 丙 |
| 实验操作 |
|
|
|
| 实验现象 | 试纸变色,对比比色卡,pH<7 |
| 产生白色沉淀 |
| 实验结论 | 溶液中有HCl | 溶液中有HCl | 溶液中有HCl |
【推论与分析】上述实验方案中有两处明显错误:
 ①实验操作中的错误是 ;
①实验操作中的错误是 ;
②实验结论中有一个是错误的,错误的原因是 ;
通过对上述实验的正确操作,同学们得出了正确的结论。
你认为【假设猜想】中 是正确的。
(3)在20g10%的氢氧化钠溶液中加入25g稀盐酸恰好完全反应。
计算25g稀盐酸中溶质的质量分数 (计算结果精确到0.1%)。
查看答案和解析>>
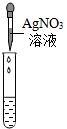
科目:初中化学 来源:2013年上海市长宁区中考化学二模试卷(解析版) 题型:解答题
| 实验方案 | 甲 | 乙 | 丙 |
实验操作 |  | 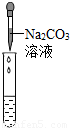 | 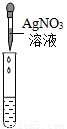 |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | ______ | 产生白色沉淀 |
| 实验结论 | 溶液中有HCl | 溶液中有HCl | 溶液中有HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com