
【题目】某同学在帮助实验员整理化学试剂时发现了一瓶标签残缺的无色溶液(如图甲所示),经实验员分析可知原瓶溶液中的溶质可能是NaCl、NaOH、Na2CO3、NaHCO3中的一种,为确认溶液中的溶质,他设计并进行了如下探究活动。
(资料查阅)上述四种物质的相关信息如下:
物质 | NaCl | NaOH | Na2CO3 | NaHCO3 |
常温下的溶解度/g | 36 | 109 | 21.5 | 9.6 |
常温下稀溶液的pH | 7 | 13 | 11 | 9 |
请回答下列问题:
(实验探究1)
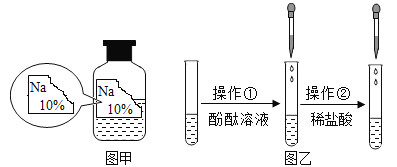
如上图乙所示,在操作①后可确定溶质不是NaCl,则实验现象应是______;在进行操作②时有无色无味气体产生,由此又可排除的物质是__________。
(探究结论)分析四种物质的相关信息,你认为该溶液中的溶质可能是上述四种物质中的______,你的判断依据是__________。若上述探究结论是正确的,操作②发生反应的化学方程式为_____________。
(讨论质疑)有同学认为以上分析不严密,需要进一步实验确定,于是又进行了如下探究。
(实验探究2)向操作①后试管中的溶液中滴加过量CaC12溶液(中性),充分反应后,试管中溶液颜色不变,又有白色沉淀产生。
(得出结论)通过实验探究2可确定原瓶溶液中的溶质应该是_________。
(反思拓展)造成该溶液出现上述实验现象的原因是______________(用化学方程式表示)。
【答案】溶液呈红色 NaOH(或氢氧化钠) Na2CO3(或碳酸钠) 碳酸氢钠饱和溶液的溶质质量分数不可能达到10%,而碳酸钠溶液可以 ![]() NaOH(或氢氧化钠)
NaOH(或氢氧化钠) ![]()
【解析】
实验探究1:
如上图乙所示,在操作①后可确定溶质不是NaCl,则实验现象应是溶液呈红色,因为NaOH、Na2CO3、NaHCO3溶液均显碱性,只有NaCl溶液显中性;在进行操作②时有无色无味气体产生,由此又可排除的物质是NaOH(或氢氧化钠),因为Na2CO3、NaHCO3与稀盐酸反应均有二氧化碳产生。
探究结论:
分析四种物质的相关信息,你认为该溶液中的溶质可能是上述四种物质中的Na2CO3(或碳酸钠),依据是碳酸氢钠饱和溶液的溶质质量分数不可能达到10%,而碳酸钠溶液可以,常温下碳酸氢钠的溶解度为9.6g,饱和溶液的溶质质量分数为![]() ,若上述探究结论是正确的,该物质是Na2CO3,操作②中Na2CO3与稀盐酸反应生成氯化钠、水和二氧化碳,发生反应的化学方程式为
,若上述探究结论是正确的,该物质是Na2CO3,操作②中Na2CO3与稀盐酸反应生成氯化钠、水和二氧化碳,发生反应的化学方程式为![]() 。
。
得出结论:
通过实验探究2,向操作①后试管中的溶液中滴加过量CaC12溶液(中性),充分反应后,试管中溶液颜色不变,又有白色沉淀产生,过量CaC12溶液将碳酸钠消耗完,生成碳酸钙白色沉淀,只有氢氧化钠使无色酚酞溶液变红,说明溶液中既有氢氧化钠也有碳酸钠,氢氧化钠与二氧化碳反应生成碳酸钠,可确定原瓶溶液中的溶质应该是 NaOH(或氢氧化钠)。
反思拓展:
造成该溶液出现上述实验现象的原因是氢氧化钠与二氧化碳反应生成碳酸钠和水,反应的化学方程式为![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
【题目】下图是初中化学实验室制取气体的常用装置图,请回答下列问题:

(1)仪器①的名称是_______。
(2)实验室制取二氧化碳选择的发生和收集装置是(填写装置下方的字母)_______。
(3)若用高锰酸钾制取氧气应选用的发生装置是______(填写装置下方的字母),写出该反应的化学方程式______,检验氧气的方法是______,排水法收集氧气不纯的原因是_________(答一点即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】中国古代四大发明之一的“黑火药”是由木炭(C)、硫粉(S)和硝酸钾(KNO3)按一定比例混合而成。
(1)分类。下列关于“黑火药”说法正确的是__________。
a “黑火药”由“黑火药分子”构成
b “黑火药”中的KNO3属于复合肥料
c “黑火药”中的C、S不再保持各自的化学性质
(2)变化。“黑火药”爆炸时发生的主要反应是:![]() 。
。
①依据质量守恒定律,空格上缺少的物质是____________(填化学式)。
②“黑火药”爆炸时能闻到刺鼻的火药味,是因为爆炸时除了有硫化物,还有硫的氧化物生成。硫在空气中燃烧的化学方程式为___________。
(3)制备。古代曾用硝土(含有Ca(NO3)2、少量NaCl等)和草木灰(含有K2CO3)作原料制取KNO3。某化学兴趣小组设计了如下实验流程:
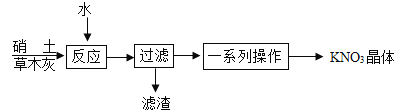
①“反应”过程中的化学方程式为____________。
②“过滤”操作必须用到的玻璃仪器有烧杯、玻璃棒和___________。
③如图是硝酸钾和氯化钠的溶解度曲线。“一系列操作”包括“加热蒸发浓缩、再冷却到一定温度、过滤”等步骤。其中“冷却到一定温度”能获得纯度较高的硝酸钾晶体的原因是____________。

(4)发展。现代国防、开矿等使用的烈性炸药,主要成分为硝化甘油(C3H5O9N3)。
①硝化甘油在人体内能缓慢氧化生成一种氮的氧化物,用于治疗心绞痛。该氧化物中氮为+2价,其化学式为____________。合成硝化甘油的化学方程式为![]() 。现用46kg甘油(C3H8O3)和足量硝酸反应,理论上能生成多少硝化甘油?__________(写出计算过程)
。现用46kg甘油(C3H8O3)和足量硝酸反应,理论上能生成多少硝化甘油?__________(写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该溶液的过程如下图所示。下列说法不正确的是
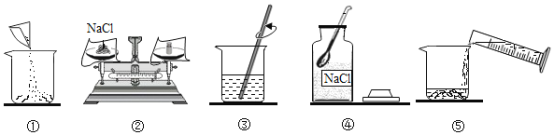
A.实验操作顺序为④②①⑤③
B.②中需称量NaCl的质量为16.0g
C.选用100mL量筒量取所需水的体积
D.用量筒量取水时仰视读数所得溶液的溶质质量分数偏大
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】作图法是常用的数据处理方法。如图是A、B、C三种物质的溶解度曲线图,请回答下列问题:
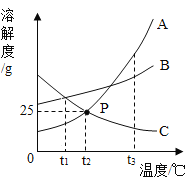
(1)P点的意义是__________。
(2)t3℃时,A、B、C三种物质溶解度最大的是_______。
(3)将某温度下C的不饱和溶液变成饱和溶液的方法是___________。(写一种)
(4)在t3℃时,将A、B、C的饱和溶液分别降温到t1℃时所得溶液溶质的质量分数由大到小的顺序是_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室常采用分解过氧化氢的方法制取氧气。下列有关过氧化氢的叙述错误的是
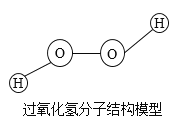
A.过氧化氢是由氢、氧两种元素组成的
B.过氧化氢中氧元素的质量分数最大
C.过氧化氢是由氢、氧两种原子构成的
D.1个过氧化氢分子是由2个氢原子和2个氧原子构成的
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某同学为了测定CaCl2和CaCO3固体混合物中CaCO3的质量分数,进行如下实验:将20g固体混合物放于烧杯内,再取100g盐酸,平均分成五份,依次加入,获得如下实验数据:
实验次数 | 一 | 二 | 三 | 四 | 五 |
加入盐酸溶液的质量(g) | 20 | 20 | 20 | 20 | 20 |
生成气体的总质量(g) | 1.1 | m | 3.3 | 4.4 | 4.4 |
问:(1)表中m的值为 g;
(2)原固体混合物中的CaCO3质量分数为 。
(3)恰好完全反应时所得溶液的溶质质量分数?(要求写出计算过程)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~E是初中化学常见的五种不同类别的物质。A是世界年产量最高的金属,C常用于改良酸性土壤。它们相互之间的关系如图所示。“一”表示两种物质之间可以相互反应,“→”表示一种物质可以生成另一种物质。
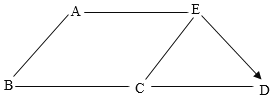
请回答下列问题:
(1)物质E的化学式是______(写一个即可),A与E能发生反应的原因是_____。
(2)B与C反应的现象是______,C与E反应的实质是_______。
(3)E→D的化学反应方程式是____(写一个即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com