
���� ���ݷ�Ӧ�ķ���ʽ��������������������ɵ��������������������Ͳμӷ�Ӧ��NaCl���������ٸ������������ļ��㹫ʽ���㼴�ɣ�
��� �⣺��1��������Cl2������Ϊx���μӷ�Ӧ��NaCl������Ϊy�������������Ƶ�����Ϊz
2NaCl+2H2O$\frac{\underline{\;ͨ��\;}}{\;}$2NaOH+H2��+Cl2��
117 80 2 71
z y 0.2g x
$\frac{117}{z}=\frac{80}{y}=\frac{2}{0.2g}=\frac{71}{x}$
��ã�x=7.1g y=8g z11.7g
��2������NaOH��Һ�����ʵ���������Ϊ��$\frac{8g}{87.3g-0.2g-7.1g}��100%$=10%
�ʴ�Ϊ����1��7.1��11.7����2������NaOH��Һ�����ʵ���������Ϊ10%��
���� ���������û�ѧ����ʽ�ļ����⣬��Ϊ��������ķ���ʽ�Ѿ�������ʹ�ѶȽ����˺ܶ࣬����Ҫ����������������Ĺ�ʽ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
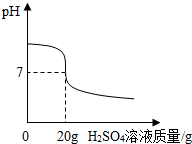 ijС������4.9%��ϡH2SO4��һƿ��ǩ�����NaOH��Һ������������
ijС������4.9%��ϡH2SO4��һƿ��ǩ�����NaOH��Һ�������������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �кͷ�Ӧ�����κ�ˮ�����������κ�ˮ�ķ�Ӧһ�����кͷ�Ӧ | |
| B�� | ���������ɲ�ͬ��Ԫ����ɵĴ���������ɲ�ͬ��Ԫ����ɵĴ�����һ���ǻ����� | |
| C�� | ������ֻ����һ��Ԫ�أ�����ֻ����һ��Ԫ�ص�����һ���ǵ��� | |
| D�� | ��ͬһ�������У�����Ԫ�������ۣ����Էǽ���Ԫ��һ���Ը��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ����֮���м�϶ | B�� | �����ڲ����˶� | C�� | ���Ӻ�С | D�� | �����ǿɷֵ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ������������ | B�� |  ������ϩ����ʳƷ��װ | ||
| C�� |  �ɱ������˹����� | D�� |  ϡ������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 44% | B�� | 46% | C�� | 50% | D�� | 55% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  ȡ��ʳ�� | B�� |  �������� | C�� |  ����Һ�� | D�� |  ϡ��Ũ���� ϡ��Ũ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com