
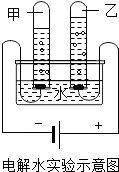
 水是生命的源泉,也是不可缺少的资源.
水是生命的源泉,也是不可缺少的资源.
| ||
| ||


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
 如图是某固体物质的溶解度曲线,根据图示回答下列问题.
如图是某固体物质的溶解度曲线,根据图示回答下列问题.查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、用肥皂水可区分硬水和软水 |
| B、水是取之不尽用之不竭的 |
| C、长期饮用蒸馏水对人体健康有益 |
| D、雨水是纯净物 |
查看答案和解析>>
科目:初中化学 来源: 题型:
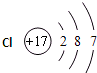
| A、它们的质子数相同 |
| B、它们的核外电子数不相同 |
| C、它们的电子层数不相同 |
| D、它们都是氯元素 |
查看答案和解析>>
科目:初中化学 来源: 题型:
| A、未说明药品用量时,液体取半试管左右,固体只需盖满试管底部 |
| B、油污可以用稀盐酸除去 |
| C、点燃可燃性气体前,必须检查气体的纯度 |
| D、加热试管里的液体时,试管口可以朝着自己,但不可以朝着别人 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com