
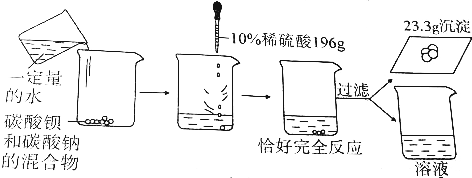
分析 (1)根据碳酸钡和硫酸反应生成硫酸钡沉淀、水和二氧化碳进行分析;
(2)根据碳酸钡和硫酸反应的化学方程式,以及题中的数据进行计算;
(3)根据碳酸钡反应的硫酸的质量,计算出和碳酸钠反应的硫酸的质量,然后计算参加反应的碳酸钠的质量,然后计算质量比;
(4)根据碳酸钠和硫酸反应生成硫酸钠、水和二氧化碳,依据硫酸的质量计算生成二氧化碳的质量;
(5)根据题中的数据计算出溶质和溶剂的质量,然后计算计算加入水的质量.
解答 解:(1)碳酸钡和硫酸反应生成硫酸钡沉淀、水和二氧化碳,化学方程式为:BaCO3+H2SO4=BaSO4↓+H2O+CO2↑;
(2)设参加反应的碳酸钡质量x,参加反应的硫酸的质量为y,生成二氧化碳质量为m
BaCO3+H2SO4=BaSO4↓+H2O+CO2↑
197 98 233 44
x y 23.3g m
$\frac{197}{x}$=$\frac{233}{23.3g}$=$\frac{98}{y}$=$\frac{44}{m}$
x=19.7g
y=9.8g
m=4.4g
硫酸的溶质质量为:10%×196g=19.6g
设参加反应的碳酸钠质量为z,生成二氧化碳质量为n,生成硫酸钠质量为b
Na2CO3+H2SO4=Na2SO4+H2O+CO2↑
106 98 142 44
z 9.8g b n
$\frac{106}{z}$=$\frac{98}{9.8g}$=$\frac{44}{n}$=$\frac{142}{b}$
z=10.6g
n=4.4g
b=14.2g
(3)10.6g:19.7g=106:197;
(4)产生二氧化碳的质量为4.4g+4.4g=8.8g;
(5)加水的质量为:196g-$\frac{10%×196g}{98%}$=176g.
故答案为:(1)BaCO3+H2SO4=BaSO4↓+H2O+CO2↑;
(2)$\frac{197}{x}$=$\frac{233}{23.3g}$;
(3)106:197;
(4)8.8g;
(5)176g.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.


 名校课堂系列答案
名校课堂系列答案科目:初中化学 来源: 题型:填空题
| 选项 | 实验目的 | 实验方案 |
| A | 证明分子在不断运动 | 向一瓶纯净水中加入少量品红 |
| B | 除去铁粉中混有的少量铜粉 | 加入足量的稀盐酸,过滤 |
| C | 提纯混有少量Na2CO3的NaCl固体 | 加入适量的稀硫酸,蒸发 |
| D | 鉴别羊毛制品和涤纶制品 | 分别灼烧,闻气味 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Zn+CuSO4═Cu+ZnSO4 | B. | Ca(OH)2+CO2═CaCO3↓+H2O | ||
| C. | CaCO3+2HNO3═Ca(NO3)2+H2O+CO2↑ | D. | NaOH+CuSO4═NaSO4+Cu(OH)2↓ |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 红磷在空气中燃烧,产生大量白烟 | |
| B. | 测定空气中氧气含量的实验里,铜丝由红色变成黑色 | |
| C. | 熟石灰与氯化铵混合研磨,生成无色无味气体 | |
| D. | 将生铁粉末投入盛有过量盐酸的烧杯中,充分反应后仍有黑色残渣 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 铁粉生锈与空气中的水蒸气和氧气有关 | |
| B. | 氢氧化钠潮解变质与空气中的水和二氧化碳有关 | |
| C. | 氧化钙的变质与空气中的水和二氧化碳有关 | |
| D. | 浓盐酸暴露在空气中变稀与空气中的水蒸气有关 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com