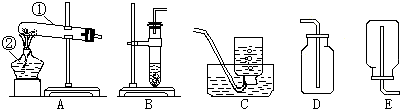
解:(1)长颈漏斗和集气瓶是实验室常用的两种仪器,故答案为:①长颈漏斗 ②集气瓶.
(2)碳酸钙和盐酸反应生成氯化钙和水和二氧化碳,在常温下反应,因此不需要加热;二氧化碳的密度比空气的密度大,能溶于水,因此只能用向上排空气法收集;二氧化碳能与水反应生成碳酸,碳酸能使紫色石蕊试液变红.故答案为:CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑、B C、二氧化碳密度比空气密度大;红色、H
2O+CO
2=H
2CO
3.
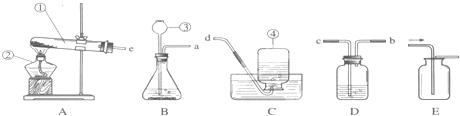
(3)二氧化锰的作用是催化作用或加快反应速度;如果测量氧气体积,连接顺序是:a→b→c→d,F装置内应该b管短c管长;如果实际测得氧气的体积大于理论值,原因可能是未冷却到室温就读数,气体体积受热造成的.故答案为:①加快反应速度或催化作用 ②b管短c管长;图略; ③未冷却到室温就读数.
(4)双氧水溶液中溶质的质量为1.36g,物质的量为0.04mol.
设0.04mol双氧水和二氧化锰产生氧气的物质的量为x
2H
2O
2
2H
2O+O
2↑
2 1
0.04mol x
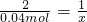
X=0.02mol
答:完全反应后生成氧气的物质的量为0.02mol.
故答案为:0.02mol.
分析:本题主要考查二氧化碳的实验室制法和收集方法,在常温下用石灰石和稀盐酸来制取二氧化碳,因此不需要加热.二氧化碳的密度比空气的密度大,能溶于水,因此只能用向上排空气法收集.二氧化碳有三个化学性质:既不能燃烧也不能支持燃烧,还不能供给呼吸;能与水反应生成碳酸,碳酸能使紫色石蕊试液变红;能与石灰水反应(即能与碱溶液反应).在用氯酸钾和二氧化锰制氧气的实验中,二氧化锰的作用是催化作用或加快反应速度;如果测量氧气体积,连接顺序是:a→b→c→d,F装置内应该b管短c管长;如果实际测得氧气的体积大于理论值,原因可能是未冷却到室温就读数,气体体积受热造成的;根据化学方程式的计算,求反应后产生氧气的物质的量.
点评:本考点主要考查气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写和有关的计算等,综合性比较强.气体的制取装置的选择与反应物的状态和反应的条件有关;气体的收集装置的选择与气体的密度和溶解性有关.本考点是中考的重要考点之一,要总体把握,本考点主要出现在实验题中.

 2H2O+O2↑
2H2O+O2↑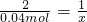


 阅读快车系列答案
阅读快车系列答案 请根据下列装置图回答问题.
请根据下列装置图回答问题.