【答案】
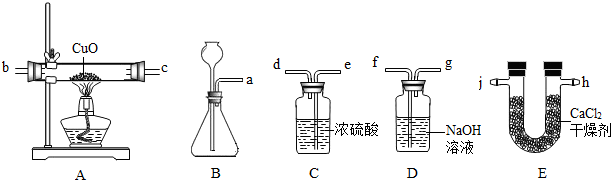
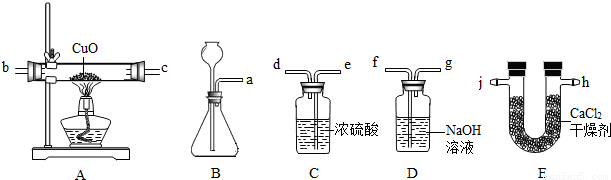
分析:(1)装置B的导管和长颈漏斗都可以排出气体,因此在检验装置气密性时,需要先把导管关闭,然后通过长颈漏斗向装置内注入水而使装置内气体被压缩而压强增大;从而达到检查装置连接处是否漏气的目的;
(2)装置B适用于固体与液体在不需要加热的条件下发生反应制取气体,因此,凡是固体与液体在常温下反应制取的气体都可使用该装置;
(3)装置C内盛有能吸收水的浓硫酸,气体通过浓硫酸时,混在气体中的水分吸收,达到干燥气体的作用;装置D中盛有氢氧化钠溶液,氢氧化钠可与HCl反应而吸收混在气体中的HCl;
(4)产生的氢气经装置C、D净化处理后通入装置A,与玻璃管内的氧化铜接触,在加热条件下,夺取氧化铜中的氧元素而生成水;
(5)装置A反应前后的质量差即是生成水中氢元素的质量,装置C反应前后质量差即为生成水的质量,装置C、A质量差的差值即为生成水中氢元素的质量;酒精灯熄灭后立即停止通氢气,空气进入玻璃管,高温下的铜会和空气中的氧气再次反应形成氧化铜,造成反应后的质量称量偏大,相应的影响到氢质量的计算结果,则最终影响到水中氢、氧元素质量比的计算结果.
解答:解:(1)检查装置B的气密性时,应先把导管关闭,防止气体从导管排出而无法判断装置气密性;当从长颈漏斗注入水时,至漏斗末端浸没在水面以下,装置内气体被压缩瓶内压强增大,如果装置不漏气,长颈漏斗内的水将不能继续流入瓶中;
故答案为:用夹子夹住a处导管,从长颈漏斗注入水,至漏斗下端管口在水面以下时停止注水,静置,漏斗内水面不再下降,气密性良好;
(2)装置B可用于固体与液体在常温下反应制取的气体;制取二氧化碳使用块状石灰石和稀盐酸,制取氧气可用粉末状二氧化锰和过氧化氢;因此,氧气、二氧化碳也可使用装置B制取;
故答案为:CO
2;
(3)产生的气体通过装置C中的浓硫酸时,气体中的水分被吸收,因此装置C的作用就是除去混在氢气中的水;产生的气体装置D中的氢氧化钠溶液时,挥发出的HCl气体会被氢氧化钠反应而除去,因此装置D的作用除去混在H
2中的HCl气体;
故答案为:除去混在H
2中的水蒸气;除去混在H
2中的HCl气体;
(4)在加热条件下,氢气可夺取氧化铜中的氧,反应生成铜和水;
故答案为:H
2+CuO?Cu+H
2O;
(5)装置A反应前后的质量差即是生成水中氢元素的质量=65.6g-59.2g,
装置C反应前后质量差即为生成水的质量=108.1g-100.8g,
装置C、A质量差的差值即为生成水中氢元素的质量=(108.1g-100.8g)-(65.6g-59.2g);
故答案为:
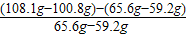
;
酒精灯熄灭后立即停止通氢气,高温下的铜会和空气中的氧气再次反应形成氧化铜,造成称量的反应前后质量差偏小,即生成水中氧元素质量偏小,相应的影响到氢质量的计算结果偏大,则最终影响到水中氢、氧元素质量比的计算结果;
故答案为:偏高.
点评:本题中水的组成元素质量比是由实验所得数据进行计算的,其中氧化铜与玻璃在反应前后的质量差为失去的氧元素的质量,而不是生成水的质量,因为反应前的称量并不包括氢的质量.

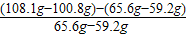 ;
;