

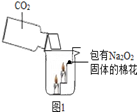

| 实验步骤 | 实验现象 |
| ①取15 g变质粉末于一支大试管内,加入适量的水,共收集到1.6g气体,然后用带火星木条检验生成的气体。 | 固体完全溶解,有气泡产生,带火星的小木条复燃 |
| ②继续向上述试管中加入足量的石灰水,充分反应。 | 有白色沉淀生成 |
| ③将②中物质过滤,得到滤渣,将其洗涤、干燥并称量,得固体5g。 | |


科目:初中化学 来源:不详 题型:实验题
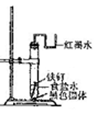
| 实验步骤 | 实验现象 | 实验结论 |
| 你选用的试剂是: 。 | | |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题

|

|
| 比较项目 | 排水法 | 向上排空气法 |
| 收集方法可行性分析 | CO2气体生成和从水面逸出的速度远大于其溶解和与水反应的速度 | CO2密度比空气 , 且不与氧气反应 |
| 收集过程分析 | 集满现象 | 验满分析:因气体无色,故集满较难确定,即便用燃着木条移近容器口火焰熄灭,也难证明空气全排尽 |
| 向收集到CO2的集气瓶中倒入等体积适量澄清石灰水,振荡 | 先浑浊后澄清所需时间较短 | 先浑浊后澄清所需时间较长 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
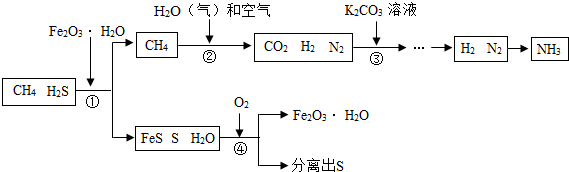
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
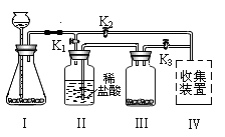
查看答案和解析>>
科目:初中化学 来源:不详 题型:单选题
| A.比较 | B.归纳 | C.理性思维分析 | D.实验分析 |
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
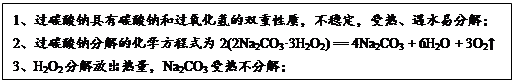
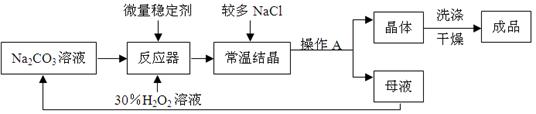
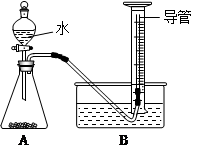
查看答案和解析>>
科目:初中化学 来源:不详 题型:实验题
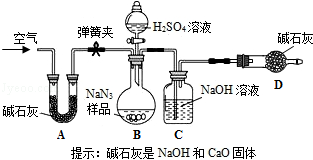

查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com