


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ2012-2013ѧğ½ĖÕŹ”£Ø¼ÆĶÅ£©¾ÅÄź¼¶ĻĀŃ§ĘŚĘŚÖŠæ¼ŹŌ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
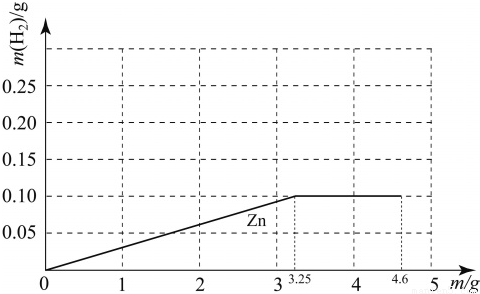
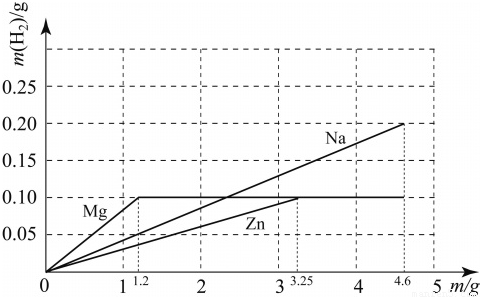
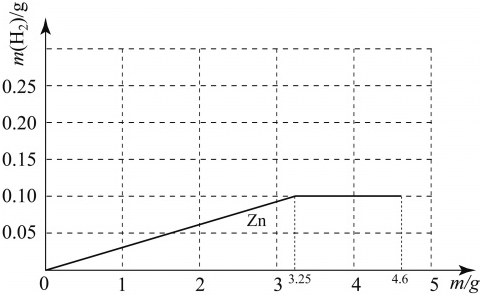
ŅŃÖŖÄĘÓėĖ®·“Ó¦µÄ»Æѧ·½³ĢŹ½ĪŖ£ŗ2Na+2H2O= 2NaOH+ H2”ü”£ÖŹĮæ¾łĪŖm gµÄÄĘ”¢Ć¾”¢ŠæČżÖÖ½šŹō·Ö±šÓė25 gÖŹĮæ·ÖŹżĪŖ19.6% µÄĻ”ĮņĖį·“Ó¦”£ÓÉÓŚ½šŹōµÄÖŹĮæ²»Č·¶Ø£¬²śÉśµÄĒāĘųµÄÖŹĮæ“óŠ”ÓŠ¶ąÖÖæÉÄܣز»æ¼ĀĒĆ¾ÓėĖ®µÄ·“Ó¦£©£¬ČēĆ¾”¢Šæ²śÉśĒāĘųµÄÖŹĮæĻąĶ¬ĒŅ¶¼“óÓŚÄĘ²śÉśµÄĒāĘųÖŹĮæµÄĒéæö±ķŹ¾ĪŖMg£½Zn >Na”£Čōm=3gŹ±£¬ĻĀĮŠ±ķŹ¾ÕżČ·µÄŹĒ
A£®Na>Mg£½Zn B£®Na=Mg£½Zn C£®Mg£½Zn >Na D£®Na>Mg>Zn
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗ³õÖŠ»Æѧ Ą“Ō“£ŗ2012-2013ѧğ½ĖÕŹ”ŃļÖŻŹŠŚõ½¾ÅÄź¼¶£ØĻĀ£©ĘŚÖŠ»ÆѧŹŌ¾ķ£Ø½āĪö°ę£© ĢāŠĶ£ŗŃ”ŌńĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com