

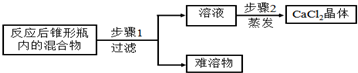
分析 (1)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热.二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集.装置C的优点是:可以控制反应的速度;
(2)过滤用玻璃棒引流,蒸发用玻璃棒不断搅拌,以防止局部温度过高而使液体飞溅;当加热至较多固体出现时,应停止加热利用余热蒸干.
解答 解:(1)实验室制取CO2,是在常温下,用大理石或石灰石和稀盐酸制取的,碳酸钙和盐酸互相交换成分生成氯化钙和水和二氧化碳,因此不需要加热;二氧化碳能溶于水,密度比空气的密度大,因此只能用向上排空气法收集,用C装置来收集二氧化碳,应长进短出;装置B的优点是:可以控制反应的速度;
(2)过滤用玻璃棒引流,蒸发用玻璃棒不断搅拌,以防止局部温度过高而使液体飞溅;当加热至较多固体出现时,应停止加热利用余热蒸干.
故答案为:①CaCO3+2HCl=CaCl2+H2O+CO2↑;②①、可以控制反应的速;(2)①玻璃棒;②较多固体出现时.
点评 本考点主要考查了气体的制取装置和收集装置的选择,同时也考查了化学方程式的书写及过滤、蒸发的操作等,难度比大.


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:初中化学 来源: 题型:选择题
| A. | 送木条是易燃物,硫磺是阻燃物 | B. | “法烛”燃烧会产生刺鼻气味 | ||
| C. | 硫磺降低了松木的着火点 | D. | 吹灭“法烛”是因为隔绝了空气 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
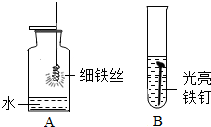 以下是初中化学有关铁的性质的一些基本实验,请回答问题.
以下是初中化学有关铁的性质的一些基本实验,请回答问题.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 反应剧烈程度:红磷燃烧比植物呼吸剧烈 | |
| B. | 硬度:金刚石比石墨大 | |
| C. | 生成物种类:化合反应比分解反应少 | |
| D. | 催化剂的质量:反应前比反应后大 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
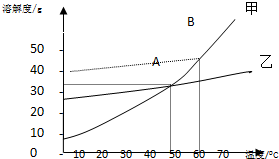 如图是甲、乙两种固体物质在水中的溶解度曲线.写出你从图中能得到的信息(至少写3个)如:温度升高,甲的溶解度增大.
如图是甲、乙两种固体物质在水中的溶解度曲线.写出你从图中能得到的信息(至少写3个)如:温度升高,甲的溶解度增大.查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com