
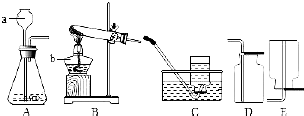
 请根据如图所示实验装置回答问题:
请根据如图所示实验装置回答问题:分析 (1)据常用仪器名称、用途回答;
(2)A装置属于固液常温型,实验室利用二氧化锰催化过氧化氢制取氧气可用此发生装置,B装置属于固体加热型,试管口有棉花,是用加热高锰酸钾的方法制取氧气,据反应原理书写方程式;
(3)据气体密度和溶解性选择收集装置,气体的溶解度随温度升高而减小,向下排空气法收集密度比空气小且不与空气中成分发生反应的气体.
解答 解:(1)标号仪器是添加液体的长颈漏斗;
(2)A装置属于固液常温型,实验室利用二氧化锰催化过氧化氢制取氧气可用此发生装置,B装置属于固体加热型,试管口有棉花,是用加热高锰酸钾的方法制取氧气,反应的化学方程式是:2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)二氧化碳密度比空气大、能溶于水,所以用向上排空气法收集,若选用装置C收集,则可以将冷水换成温水,是因为随着温度的升高,二氧化碳的溶解度减小,溶解的少;若收集某气体只能用装置E,说明该气体是易溶于水、密度比空气小且不与空气中成分发生反应的气体;
故 答案为:(1)长颈漏斗;
(2)过氧化氢、二氧化锰;2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑;
(3)D;气体的溶解度随温度升高而减小;易溶于水,密度比空气小、不与空气中成分发生反应.
点评 明确装置选取依据:发生装置据反应物状态和反应条件,收集装置据气体密度和溶解性选择,能用排空气法收集的气体不与空气中成分发生反应,并掌握制取氧气的反应原理、常用仪器、气体的溶解度随温度变化情况.


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:初中化学 来源: 题型:推断题
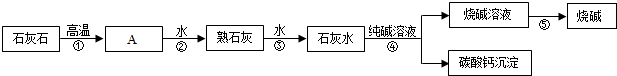
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
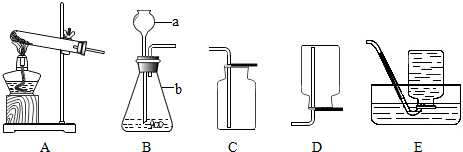
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
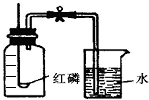 通过实验现象和题给信息,按要求填空.为测定空气的成分按如图进行实验:
通过实验现象和题给信息,按要求填空.为测定空气的成分按如图进行实验:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 所得溶液为饱和溶液 | B. | M(溶质):m(溶剂)=40:100 | ||
| C. | 所得溶液溶质质量分数约为40% | D. | 硝酸钾的溶解度为31.6g |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
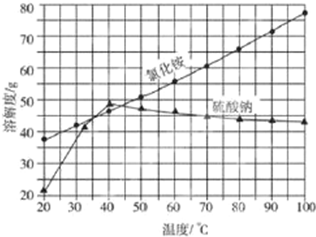
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:选择题

| A. | 甲实验试管口向下倾斜可防止氢气逸出 | |
| B. | 乙实验只能通过澄清石灰水是否变浑浊判断反应是否发生 | |
| C. | 甲、乙两实验中,都应先通入气体,再使试管、玻璃管均匀受热,以防止发生爆炸 | |
| D. | 甲、乙两实验中,氢气和一氧化碳都将氧化铜变成游离态的铜,都发生了置换反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com