汽车安全气囊是车辆安全的重要保障.当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害.为研究安全气囊工作的化学原理,取安全装置中的粉末进行实验,确定此粉末是由Na、Fe、N、O四种元素两两组合而成的两种不同的化合物.
请回答下列问题:
(1)进一步检测,其中一种化合物为NaN3(叠氮化钠);另一种物质为红色粉末甲,则甲的化学式为.
(2)NaN3(叠氮化钠)在加热的条件下可分解生成金属钠和另一种气体单质,则分解反应的化学方程式为.
(3)红色粉末甲的主要作用是与NaN3(叠氮化钠)分解生成的钠发生置换反应,防止危害,请将该反应的化学方程式补充完整6Na+()=3Na2O2+()Fe (括号内填写数字,横线上填写化学式)
【答案】
分析:(1)由物质甲为铁元素与氧元素组成的呈红色粉末状的化合物,判断甲物质并写出其化学式;
(2)根据对所发生反应的描述,利用质量守恒定律推断所得气体单质的组成,然后根据书写化学方程式的方法,写出反应的化学方程式;
(3)利用反应前后原子个数不变,由反应中部分物质的计量数,推断其它物质在反应中的计量数.
解答:解:(1)由粉末是由Na、Fe、N、O四种元素两两组合而成的两种不同的化合物,且其中一种化合物为NaN
3(叠氮化钠),则另一种化合物为氧元素与铁元素组成的化合物,又物质为红色粉末,可判断物质甲为氧化铁,其化学式为Fe
2O
3;
(2)NaN
3(叠氮化钠)在加热的条件下可分解生成金属钠和另一种气体单质,根据质量守恒定律,气体单质应为氮元素所组成的单质气体氮气,则该分解反应的化学方程式为2NaN
3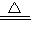
2Na+3N
2↑;
(3)根据反应前后原子个数不变,生成的3Na
2O
2中含6个O原子,则反应中红色粉末氧化铁的计量数应为2,而生成铁的计量数为4;
故答案为:
(1)Fe
2O
3;
(2)2NaN
3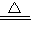
2Na+3N
2↑;
(3)2;Fe
2O
3;4.
点评:利用物质的组成特点结合物质的颜色或类别,完成对物质的推断,引乃是解决此问题的根本.

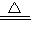 2Na+3N2↑;
2Na+3N2↑;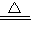 2Na+3N2↑;
2Na+3N2↑;

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案