
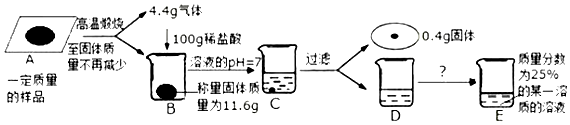
分析 高温条件下,碳酸钙分解生成氧化钙和二氧化碳,氧化钙和稀盐酸反应生成氯化钙和水,根据反应的化学方程式及其提供的数据可以进行相关方面计算和判断.
解答 解:(1)实验中A→B过程中,碳酸钙分解生成氧化钙和二氧化碳,发生反应的化学方程式为:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
故填:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑.
(2)设恰好完全反应的稀盐酸的溶质质量为x,生成氯化钙质量为y,
参加反应的氧化钙质量为:11.6g-0.4g=11.2g,
CaO+2HCl═CaCl2+H2O,
56 73 111
11.2g x y
$\frac{56}{11.2g}$=$\frac{73}{x}$=$\frac{111}{y}$,
x=14.6g,y=22.2g,
故填:$\frac{56}{11.2g}$=$\frac{73}{x}$.
(3)需要36.5%的浓盐酸的质量为:14.6g÷36.5%=40g,
用36.5%的浓盐酸配制实验中所用的稀盐酸需加水的体积为:(100g-40g)÷1g/mL=60mL,
故填:60mL.
(4)D中溶质质量分数为:$\frac{22.2g}{111.2g}$×100%=19.7%,
因此若通过改变溶剂的方式得到E中一定质量的25%的某溶液,则D→E的操作是蒸发,设蒸发水的质量为z,
根据题意有:$\frac{22.2g}{111.2g-z}$×100%=25%,
z=22.4g,
故填:22.4g.
(5)设碳酸钙质量为m,生成氧化钙质量为n,
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,
100 56 44
m n 4.4g
$\frac{100}{m}$=$\frac{56}{n}$=$\frac{44}{4.4g}$,
m=10g,n=5.6g
样品中碳酸钙的纯度为;$\frac{10g}{4.4g+11.6g}$×100%=62.5%,而样品中氧化钙的纯度为:$\frac{11.2g-5.6g}{4.4g+11.6g}$×100%=35%
故填:62.5%.
(6)制取(成分及含量相同的)该样品64g,所含氧化钙的质量为64g×35%=22.4g
设生成22.4g氧化钙时生成的二氧化碳的质量为a
CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,
56 44
22.4g a
$\frac{44}{56}$=$\frac{a}{22.4g}$
a=17.6g
需要含杂质的石灰石的质量为64g+17.6g=81.6g
故填:81.6g.(本计算需要建立在含杂质的石灰石中杂质量在一定范围内,加热部分分解碳酸钙,而成分正好符合样品比例,所以不能视为含杂质的计算)
点评 根据化学方程式计算时,第一要正确书写化学方程式,第二要使用正确的数据,第三计算过程要完整.


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:初中化学 来源: 题型:填空题
 生活中处处有化学,化学与生活密切相关.
生活中处处有化学,化学与生活密切相关.查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 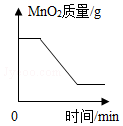 一定质量的KClO3和固体MnO2混合物受热过程中MnO2的质量变化 | |
| B. | 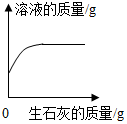 一定质量的饱和石灰水中加入生石灰 | |
| C. | 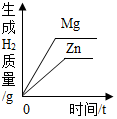 等质量的Zn和Mg分别与等体积等质量分数的稀硫酸(足量)反应 | |
| D. | 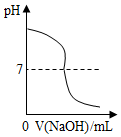 向稀盐酸溶液中逐滴加入NaOH溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④⑤ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
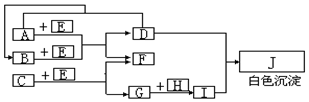
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 加油站内禁止接打手机 | B. | 熄灭酒精灯时,用嘴吹灭 | ||
| C. | 用甲醛溶液浸泡海鲜 | D. | 稀释浓硫酸时,将水注入浓硫酸中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com