
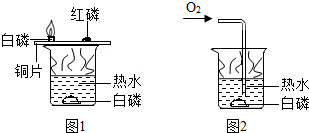
| A. | 铜片上的白磷燃烧,红磷不能燃烧,说明可燃物燃烧温度要达到着火点 | |
| B. | 铜片上的白磷燃烧,水中白磷不燃烧,说明可燃物燃烧要与氧气接触 | |
| C. | 水中白磷通过氧气前后的实验对比,说明可燃物燃烧要与氧气接触 | |
| D. | 只有图1实验,不能证明可燃物燃烧的两个条件,温度达到着火点和氧气接触 |
分析 A、铜片上的白磷、红磷都和氧气接触,温度也相同,然而白磷燃烧、红磷不燃烧,说明可燃物燃烧要达到着火点;
B、铜片上的白磷与氧气接触,水中白磷不与氧气接触,温度也相同,因此铜片上的白磷燃烧、水中白磷不燃烧,说明可燃物燃烧要与氧气接触;
C、水中白磷没通氧气前不燃烧,通氧气后燃烧,通过水中白磷通氧气前后的实验对比,可以说明可燃物燃烧要与氧气接触;
D、由AB分析知,只有图1实验,也能证明可燃物燃烧的两个条件:达到着火点和与氧气接触.
解答 解:A、铜片上的白磷、红磷都和氧气接触,温度也相同,然而白磷燃烧、红磷不燃烧,说明可燃物燃烧要达到着火点,故A说法正确;
B、铜片上的白磷与氧气接触,水中白磷不与氧气接触,温度也相同,因此铜片上的白磷燃烧、水中白磷不燃烧,说明可燃物燃烧要与氧气接触,故B说法正确;
C、水中白磷没通氧气前不燃烧,通氧气后燃烧,通过水中白磷通氧气前后的实验对比,可以说明可燃物燃烧要与氧气接触,故C说法正确;
D、由AB分析知,只有图1实验,也能证明可燃物燃烧的两个条件:达到着火点和与氧气接触,故D说法错误.
故选D.
点评 物质燃烧需要达到三个条件:物质具有可燃性、与氧气接触、达到着火点,缺一不可.


科目:初中化学 来源: 题型:实验探究题
| 测定物质 | 滴入碘水的数量(滴) |
| ①蒸馏水 | 1 |
| ②标准维生素C溶液 | 8 |
| ③橙汁 | 15 |
| ④果味饮料 | 5 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 温度/℃ | 室温 | 100 | 550 | 1400 |
| B装置/g | 200.00 | 201.80 | 205.04 | 205.04 |
| C中铜网/g | 100.00 | 100.00 | 100.00 | 101.28 |
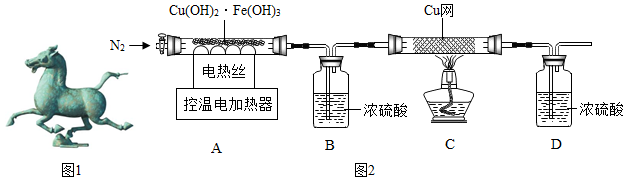
查看答案和解析>>
科目:初中化学 来源: 题型:多选题
| A. | 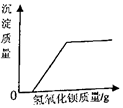 向一定量稀硫酸和硫酸钠的混合溶液中不断加入氢氧化钡溶液 | |
| B. | 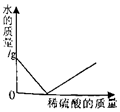 向一定量的氢氧化钡溶液中不断加入稀硫酸 | |
| C. | 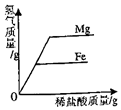 向分别盛有相同质量镁和铁的试管中,分别加入等溶质质量分数的稀盐酸至过量 | |
| D. | 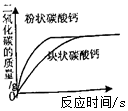 将相同质量的粉状碳酸钙和块状碳酸钙与足量相同溶质质量分数的稀盐酸混合 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | H+、Cl-、OH-、Na+ | B. | H+、Ca2+、SO42-、HCO3- | ||
| C. | Ba2-、H+、Cl-、SO42- | D. | Cu2+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com