
| A. | 大于26.5% | B. | 小于26.5% | ||
| C. | 等于26.5% | D. | 条件不足,无法判断 |
分析 在一定温度下,向一定量的溶剂里加入某种溶质,当溶质不能继续溶解时所得到的溶液叫这种溶质的饱和溶液;则在一定温度下,向氯化钠的饱和溶液中加入氯化钠,氯化钠将不再溶解,据此确定溶液中质量分数的变化情况.
解答 解:20℃时,氯化钠饱和溶液的溶质质量分数为26.5%,可知20℃时,氯化钠的溶解度为x,则$\frac{x}{100g+x}×100%=26.5%$,x=36g.可以推知20℃时100g水中最多溶解氯化钠是36g,所以该温度下5g水中最多溶解1.8g氯化钠;现在将5g氯化钠放入5g水中,显然不可能完全溶解,只能溶解1.8g.溶液仍为饱和,所以溶液中溶质的质量分数保持不变,仍为26.5%.
故选C.
点评 本题难度不大,掌握饱和溶液与溶质质量分数的概念并能灵活运用是正确解答本题的关键.


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
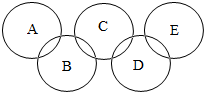 如图,A、B、C、D、E各代表铁、水、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质.常温下,相连环物质间能发生反应,不相连环物质间不能发生反应,且B的相对分子质量大于D.请填空:
如图,A、B、C、D、E各代表铁、水、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质.常温下,相连环物质间能发生反应,不相连环物质间不能发生反应,且B的相对分子质量大于D.请填空:查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
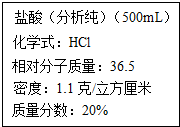 某学校实验室从化学试剂商店买回的一瓶未开封的盐酸试剂(氯化氢水溶液),试剂瓶的标签上的部分内容如图,请仔细阅读后计算
某学校实验室从化学试剂商店买回的一瓶未开封的盐酸试剂(氯化氢水溶液),试剂瓶的标签上的部分内容如图,请仔细阅读后计算查看答案和解析>>
科目:初中化学 来源: 题型:填空题
 原子得到或失去电子后形成离子.某离子的结构示意图如图
原子得到或失去电子后形成离子.某离子的结构示意图如图查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com