(2011?黄冈模拟)将Na2CO3和NaCl固体混合物22.3g加入到盛有216.1g稀盐酸的烧杯中,恰好完全反应,所得溶液中溶质的质量分数为10%.请计算稀盐酸的质量分数?(CO2的溶解忽略不计)______.
【答案】
分析:固体混合物中碳酸钠与盐酸反应放出气体二氧化碳,根据质量守恒定律,然后利用化学方程式计算混合固体中碳酸钠的质量和生成的氯化钠的质量,稀盐酸的质量分数即可计算解决.
解答:解:设固体混合物中碳酸钠的质量为x
Na
2CO
3+2HCl═2NaCl+CO
2↑+H
2O
106 73 117 44
x

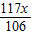
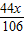
(22.3-x)g+

═(22.3 g+216.1 g-

)×10%
x=10.6 g
HCl的质量=

=
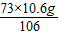
=7.3g
稀盐酸的质量分数=
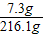
×100%=3.4%
答:稀盐酸的质量分数为3.4%.
点评:根据质量守恒定律,反应后所得溶液的质量=固体混合物的质量+稀盐酸的质量-生成二氧化碳气体的质量.

 一本好题口算题卡系列答案
一本好题口算题卡系列答案