
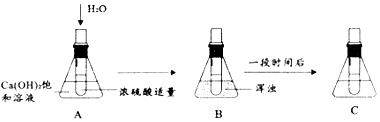
分析 (1)稀释浓硫酸的操作应该是酸入水,否则会使酸液飞溅发生危险.
(2)浓硫酸溶于水会放热,使溶液温度升高,导致氢氧化钙的溶解度变小.
(3)A、B、C中A、C是常温时的氢氧化钙的饱和溶液,B是高温时的氢氧化钙的饱和溶液,利用这一关系可解决此题.
(4)硝酸铵固体溶于水时吸热,溶液温度降低.
解答 解:(1)稀释浓硫酸的操作应该是酸入水,否则会使由于放出大量的热而使酸液飞溅发生危险,故答案为:稀释浓硫酸的操作应该是酸入水.
(2)浓硫酸溶于水会放热,使溶液温度升高,导致氢氧化钙的溶解度变小,溶质析出.故答案为:浓硫酸溶于水放热,溶液温度升高使Ca(OH)2析出.
(3)A、C是常温时的氢氧化钙的饱和溶液,B是温度升高后的氢氧化钙的饱和溶液,由于氢氧化钙的溶解度随温度升高而降低,故溶质质量分数的关系是A=C>B.
故答案为:A=C>B.
(4)硝酸铵固体溶于水时吸热,溶液温度降低,氢氧化钙的溶解度增大,因此不会出现相同的现象,答:不会.
点评 此题是溶液知识的考查,解题的重点是利用放热反应对氢氧化钙的溶液进行分析比较,属基础性知识考查题.


科目:初中化学 来源: 题型:填空题
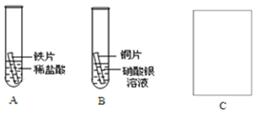 如图所示,小明想通过实验证明铁、铜、银三种金属的活动性顺序.
如图所示,小明想通过实验证明铁、铜、银三种金属的活动性顺序. .
.查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 类 别 | 物 质 |
| A | 合金 | 黄铜、生铁 |
| B | 碱 | 烧碱、纯碱 |
| C | 有机物 | 蛋白质、葡萄糖 |
| D | 腐蚀性物质 | 浓硫酸、氢氧化钠 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
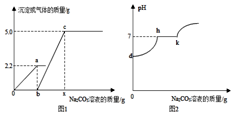 小科同学在实验室制取CO2气体后,对废液进 行探究,他向一定质量的含CaCl2和HCl的废液中逐滴加入溶质质量分数为10%的Na2CO3溶液.实验过程中加入Na2CO3溶液质量与产生沉淀或气体的质量关系如图1所示:加入Na2CO3溶液的质量与溶液的pH变化关系如图2所示,请写出h-k段的化学方程式Na2CO3+CaCl2=CaCO3↓+2NaCl,a点溶液中所含溶质为NaCl和CaCl2(用化学式表示).
小科同学在实验室制取CO2气体后,对废液进 行探究,他向一定质量的含CaCl2和HCl的废液中逐滴加入溶质质量分数为10%的Na2CO3溶液.实验过程中加入Na2CO3溶液质量与产生沉淀或气体的质量关系如图1所示:加入Na2CO3溶液的质量与溶液的pH变化关系如图2所示,请写出h-k段的化学方程式Na2CO3+CaCl2=CaCO3↓+2NaCl,a点溶液中所含溶质为NaCl和CaCl2(用化学式表示).查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 现有18gFe2O3和CuO的混合物,进行如下实验:把混合物全部加入到100g足量的硫酸溶液中,完全溶解后,滴加溶质质量分数为16%的氢氧化钠溶液,滴加氢氧化钠溶液的质量与生成沉淀质量的关系如图所示,回答下列问题:
现有18gFe2O3和CuO的混合物,进行如下实验:把混合物全部加入到100g足量的硫酸溶液中,完全溶解后,滴加溶质质量分数为16%的氢氧化钠溶液,滴加氢氧化钠溶液的质量与生成沉淀质量的关系如图所示,回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
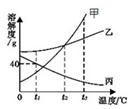 如图所示为甲乙丙三种物质的溶解度曲线,在甲乙丙三中接近饱和的溶液中,通过加入溶质、蒸发溶剂(温度都不变)、升温均可变为饱和溶液的是( )
如图所示为甲乙丙三种物质的溶解度曲线,在甲乙丙三中接近饱和的溶液中,通过加入溶质、蒸发溶剂(温度都不变)、升温均可变为饱和溶液的是( )| A. | 甲溶液 | B. | 乙溶液 | C. | 丙溶液 | D. | 甲乙丙均可 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 在一定质量的甲溶液中逐渐加入乙至过量,反应过程中溶液的总质量与加入乙的质量的关系,能用如图曲线表示的是( )
在一定质量的甲溶液中逐渐加入乙至过量,反应过程中溶液的总质量与加入乙的质量的关系,能用如图曲线表示的是( )| 选项 | 甲溶液 | 乙 |
| A | HCl溶液 | KOH溶液 |
| B | BaCl2溶液 | Na2CO3溶液 |
| C | H2SO4溶液 | 锌粒 |
| D | CuSO4溶液 | NaOH溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验 | 1 | 2 | 3 | 4 |
| 加入盐酸的质量/g | 50 | 100 | 150 | 200 |
| 生成CO2的质量/g | 1.76 | 3.52 | 4.4 | m |
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com