
| 100 |
| x |
| 73 |
| y |
| 111 |
| z |
| 44 |
| 4.4g |
| 10g |
| 12.5g |
| 7.3g |
| 100g |
| 11.1g |
| 10g+100g-4.4g |


科目:初中化学 来源: 题型:
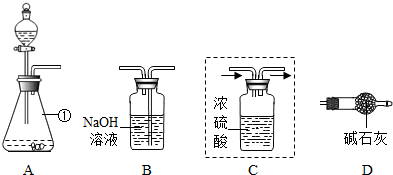
查看答案和解析>>
科目:初中化学 来源: 题型:
 某化学兴趣小组为测定大理石中碳酸钙的含量,将过量的稀盐酸加入到20g大理石中(其它成分不与盐酸反应),把产生的CO2气体用足量的NaOH溶液吸收,同时测量2分钟内NaOH溶液增加的质量,结果如下表所示:
某化学兴趣小组为测定大理石中碳酸钙的含量,将过量的稀盐酸加入到20g大理石中(其它成分不与盐酸反应),把产生的CO2气体用足量的NaOH溶液吸收,同时测量2分钟内NaOH溶液增加的质量,结果如下表所示:| 时间/s | O | 20 | 40 | 60 | 80 | 100 | 120 |
| 增加的质量/g | O | 3.O | 5.O | 6.O | 6.6 | 6.6 | 6.6 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:
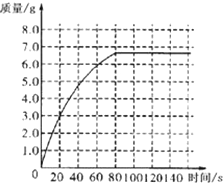 某化学兴趣小组为测定大理石中碳酸钙的含量,将过量的稀盐酸加入到20g大理石中(其它成分不与盐酸反应),把产生的CO2气体用足量的NaOH溶液吸收,同时测量2分钟内NaOH溶液增加的质量,结果如表所示:
某化学兴趣小组为测定大理石中碳酸钙的含量,将过量的稀盐酸加入到20g大理石中(其它成分不与盐酸反应),把产生的CO2气体用足量的NaOH溶液吸收,同时测量2分钟内NaOH溶液增加的质量,结果如表所示:| 时间/s | O | 20 | 40 | 60 | 80 | 100 | 120 |
| 增加的质量/g | O | 3.0 | 5.0 | 6.0 | 6.6 | 6.6 | 6.6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com