

| 100 |
| 72 |
| x |
| 72kg |
| 100kg |
| 110kg |


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:初中化学 来源: 题型:
| A、C29H50O2中氧元素的质量分数约为7.4% |
| B、C29H50O2属于氧化物 |
| C、氢元素和氧元素元素的质量比25:16 |
| D、2 C29H50O2表示2个维生素E分子 |
查看答案和解析>>
科目:初中化学 来源: 题型:
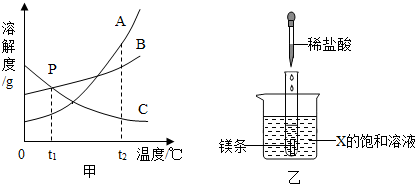
查看答案和解析>>
科目:初中化学 来源: 题型:
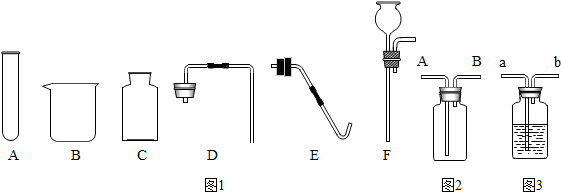
查看答案和解析>>
科目:初中化学 来源: 题型:
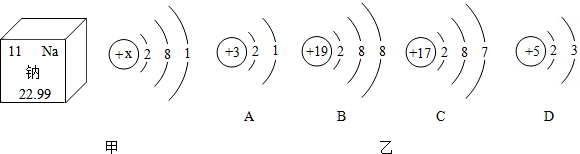
查看答案和解析>>
科目:初中化学 来源: 题型:
| 盐酸溶液浓度 | 反应开始时酸 溶液的温度 | 反应开始到2分钟产生的气体体积 | 反应结束共产生气体体积 |
| 5% | 20℃ | 10mL | 60mL |
| 10% | 20℃ | 19mL | 118mL |
| 15% | 20℃ | 28mL | 175mL |
| 5% | 35℃ | 28mL | 60mL |
| 10% | 35℃ | 72mL | 118mL |
| 15% | 35℃ | 103mL | 175mL |
查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com