
| A. | 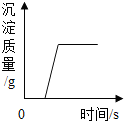 向一定量的盐酸和CaCl2混合溶液中的第如Na2CO3溶液 | |
| B. | 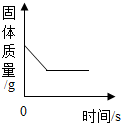 加热氯酸钾和二氧化锰的混合物 | |
| C. | 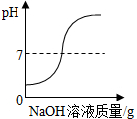 向一定量的盐酸中滴入NaOH溶液 | |
| D. | 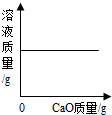 一定温度时,向一定量的饱和石灰水中加入生石灰 |
分析 A.根据盐酸和氯化钙与碳酸钠反应的原理分析即可.其中加入的碳酸钠先与盐酸反应,盐酸反应完后,加入的碳酸钠才与氯化钙反应生成白色的碳酸钙沉淀.
B、根据氯酸钾的质量等于氯化钾与氧气的质量总和,即反应后固体质量减小解答;
C、由pH值变化情况图,随溶液的加入溶液的酸碱度逐渐升高,由小于7到等于7再到大于7;
D、根据氧化钙能与水发生反应生成氢氧化钙进行分析;
解答 解:A、向盐酸和氯化钙的混合溶液中滴加碳酸钠时,碳酸钠先于盐酸反应,所以刚开始加入碳酸钠时无沉淀生成,当盐酸消耗完后,继续加入的碳酸钠开始与氯化钙反应,生成碳酸钙沉淀,所以此时才开始有沉淀生成,当氯化钙消耗完后沉淀量不再增加;正确;
B、根据质量守恒定律,氯酸钾的质量等于氯化钾与氧气的质量总和,即反应后固体质量减小,当氯酸钾完全反应后,固体总质量不再变化,会形成水平线,故对;
C、由pH值变化情况图,随氢氧化钠溶液的加入溶液的酸碱度逐渐升高,由小于7到等于7再到大于7,说明图示正确,故C正确;
D、由于氧化钙能与水发生反应生成氢氧化钙,氧化钙反应消耗了饱和溶液中的水,而使饱和溶液因减少溶剂水而析出固体,饱和溶液的溶质、溶剂质量同时减少,所以溶液的质量减少,故D错误;
答案:D.
点评 此题是化学反应、及化学实验与图象知识的考查题,要结合反应和实验的过程与图象情况的走势联系起来,这是解题的关键所在.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:选择题
| A. | 食用瘦肉等含铁食物预防缺铁性贫血 | |
| B. | 用熟石灰改良碱性土壤 | |
| C. | 用二氧化碳灭火器扑灭图书、档案等物的失火 | |
| D. | 医疗上用氯化钠配制生理盐水 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
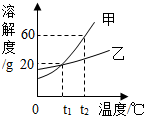 如图所示为甲、乙两物质的溶解度曲线,请你根据曲线回答以下问题:
如图所示为甲、乙两物质的溶解度曲线,请你根据曲线回答以下问题:查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 实验序号 | 10%的H2O2 溶液(mL) | 溶液中加入 物质(g) | 收集到气体的 体积(mL) |
| 1 | 100 | 无 | a |
| 2 | 100 | Fe2O30.5g | b |
| 3 | 100 | MnO20.5g | c |
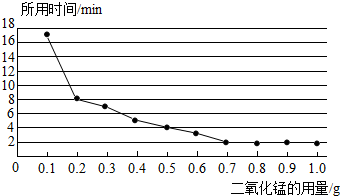
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com