三明钢铁厂的化验员小曹为了检测生铁产品中铁的质量分数,取研磨成粉末的2.9g生铁样品放入烧杯中,向其中滴加溶质的质量分数为7.3%的稀盐酸直到恰好不再产生气泡,共用去这种稀盐酸50g(反应的化学方程式为Fe+2HCl=FeCl2+H2↑,生铁中杂质不参与反应).求:
(1)溶质的质量分数为7.3%的50g稀盐酸中溶质的质量为______g.
(2)生铁样品中铁的质量分数(精确到0.1%).
【答案】
分析:(1)利用溶质质量=溶液质量×溶质的质量分数,可根据溶液的质量和溶质的质量分数计算稀盐酸中溶质的质量.
(2)由稀盐酸中溶质的质量,根据反应的化学方程式计算出生铁样品中铁的质量,进而计算出生铁样品中铁的质量分数.
解答:解:(1)溶质的质量分数为7.3%的50g稀盐酸中溶质的质量为50g×7.3%=3.65g.
(2)设生铁样品中铁的质量为x.
Fe+2HCl=FeCl
2 +H
2↑
56 73
x 3.65g
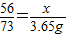
x=2.8g
∴生铁样品中铁的质量分数=
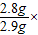
100%≈96.6%.
答:(1)3.65.
(2)生铁样品中铁的质量分数为96.6%.
点评:本题难度不大,掌握溶质质量分数的有关计算、利用化学方程式的计算是可正确解答本题的关键,解题时要注意解题的规范性.

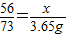 x=2.8g
x=2.8g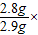 100%≈96.6%.
100%≈96.6%.

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案