
【题目】现有符号①2O ②N2 ③2O3 ④2CO ⑤2N3- ⑥SO42- ⑦3Fe3+ ⑧H2O ⑨![]() ,其中数字“2”表示的含义不同,下列判断正确的是( )
,其中数字“2”表示的含义不同,下列判断正确的是( )
A. 表示分子个数:①③ B. 表示离子个数:⑤⑦
C. 表示原子个数:②④⑧ D. 表示化合价:⑥⑨
科目:初中化学 来源: 题型:
【题目】通过学习,我们掌握了制备氧气的一些方法,例如:A.分离空气 B.加热分解高锰酸钾 C.分解过氧化氢 D.加热分解氯酸钾 E.电解水等等;也熟悉一些气 体的制取和收集装置,例如:
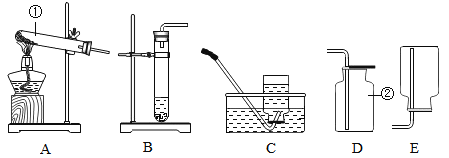
(1)以上制取氧气的方法中,要用到催化剂的反应有____(填字母,下同)。
(2)在上述收集装置中,既可用来收集氧气,又可用来收集氢气的是____。
(3)若以加热分解氯酸钾制取氧气为例,应选用的发生装置是____;并写出对应的文字表达式____。该反应的基本反应类型是____(填“化合反应”或“分解反应”)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是甲、乙两种固体物质的溶解度曲线。

(1)读图,你获得的信息是____________________。
(2)t2 ℃时,将等质量的甲、乙两种物质加水溶解配制成饱和溶液,所得溶液质量的大小关系:甲______乙(填 “>”、“<”或“=”,下同),溶质质量分数大小关系:甲 ______ 乙
(3)把甲物质的不饱和溶液变为饱和溶液,下列有关说法正确的是________(填序号,下同)。
A.溶剂的质量一定变小 B.溶质的质量可能不变
C.溶质的质量分数一定变大 D.溶液的质量一定变大
E.该饱和溶液还可以溶解其他物质
(4)通常情况下,在实验室用固体甲配制一定溶质质量分数的甲溶液,需用到的仪器有托盘天平(带砝码盒)、烧杯和____________。
A.酒精灯 B.药匙C.玻璃棒 D.漏斗E.铁架台F.量筒G.胶头滴管
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】氮气是一种重要的工业原料,广泛应用于化肥等工业.工业常用PSA变压吸附制氮气,某学习小组查阅到相关制氮气工艺流程(如图1),并展开学习,请回答相关问题:

【查阅资料】:
①在同等条件下,碳分子筛对不同气体的吸附强度不同,如图2所示;

②碳分子筛可以再生,能重复使用.
(1)吸附塔中碳分子筛具有吸附性,这种性质是______(填“化学”或“物理”)性质,根据图2所示,要增强碳分子筛的吸附能力,可采取的方法___________;
(2)氮气化学性质比较稳定,写出与之相关的一条用途_______,N2和另一种单质气体在500℃、200MPa及催化剂的条件下发生反应,生成NH3,反应的化学方程式为_____。
(3)对于该工艺的说法准确的是_____(填字母)。
A.碳分子筛再生的方法是,降低吸附塔中压强,利用N2吹扫,使被吸附气体和碳分子筛分离
B.相对于分离液态空气,该工艺的优点是无需将空气液化
C.碳分子筛可以重复使用,成本低廉。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】二百多年前,法国化学家拉瓦锡用定量的方法研究了空气的成分。仿照这个历史上著名实验的原理,我们可以用图1所示装置来测定空气中氧气的含量。

【提出问题】用红磷燃烧的方法为什么测出的氧气含量远低于21%?
【分析讨论】(1)实验装置漏气;(2)________________,导致装置内氧气有剩余;(3)……
【实验与交流】在老师的指导下,同学们查阅了白磷、红磷等物质燃烧需要的最低含氧量如下:
资料1:
可燃物名称 | 红磷 | 白磷 | 蜡烛 |
最低含氧量/% | 8.0 | 4.0 | 16.0 |
甲、乙、丙三个小组分别用上述过量红磷、白磷、蜡烛三种物质进行该实验,用测氧气浓度的传感器测得反应后的氧气浓度分别为8.85%、3.21%、16.7%,数据与表中的理论值基本一致。其中蜡烛燃烧后用测一氧化碳浓度传感器测算一氧化碳浓度约为2%。
资料2:蜡烛或者木炭在密闭的集气瓶中燃烧,氧气浓度会不断变小,会有一氧化碳气体生成。常温下一氧化碳难溶于水,且不与澄清石灰水反应。根据以上信息回答下列问题:
(1)白磷和红磷相比,使用白磷能使结果更准确,其原因是_______________________。
(2)请写出红磷燃烧的化学方程式______________,该反应属于___________反应(填一种基本反应类型);有同学提议选用木炭替代红磷做实验,在集气瓶底部预先放少量澄清石灰水吸收生成的二氧化碳气体,小华觉得不可行,其主要原因是________________。
(3)兴趣小组用白磷代替红磷进行实验,已知化学反应前后元素种类和质量都不发生改变,若该实验中消耗的氧气质量为0.8克,则理论上生成的五氧化二磷的质量为______。
【实验拓展】某校研究性学习小组用下图装置进行镁条在空气中燃烧的实验。燃烧、冷却后打开止水夹,进入集气瓶中水的体积约占集气瓶体积的70%。
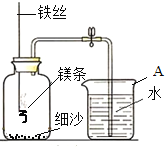
(4)实验过程中,若弹簧夹未夹紧,则进入集气瓶中的水会_______(选填“偏大”、“偏小”或“不变”)。
(5)如果镁条只和空气中的氧气反应,则进入集气瓶中水的体积最多不超过其容积的_______,现进入集气瓶中水的体积约为其容积的 70%,根据空气的组成可推出减少的气体中还一定有氮气,其理由是______________________。
【提出问题】氮气是怎样减少的呢?
【作出假设】氮气是与镁条反应而减少的。
【查阅资料】
①镁条在空气中燃烧时,不仅与空气中的氧气反应生成氧化镁,还能与氮气反应生成氮化镁(氮化镁中氮元素的化合价为-3价),请写出镁条与氮气反应的化学方程式__________;
②镁条除了能与氮气反应,还可以在二氧化碳气体中燃烧生成碳和氧化镁,请你写出该反应的化学方程式___________
【验证实验】用坩埚钳夹持镁条,点燃后迅速伸入盛有氮气的集气瓶中,镁条燃烧,发出暗红色火焰,生成淡黄色粉末,并放出大量的热。
【得出结论】镁条能在氮气中燃烧生成固体氮化镁。
【实验反思】通过以上实验探究,我们可以知道用于测定空气中氧气含量所选用的药品,应符合的条件是____________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】物质之间的相互转化关系如下图所示。已知:A、B均是无色液体,E是最常见的金属,F是黑色固体。(已知:氢气和金属氧化物在加热的条件下反应生成金属单质和水)
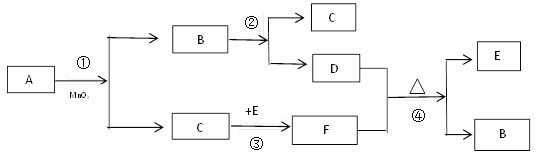
(1)A的化学式为_________________;
(2)反应③的基本反应类型是_________________;
(3)反应②的符号表达式__________________________________;
(4)反应④的符号表达式__________________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】若将一定量的某中电池燃料R和氧气置于封闭的容器中,在一定条件下充分反应,测定反应前后各物质的质量如下表,不正确的是( )
物质 | R | 氧气 | 水 | 二氧化碳 |
反应前质量 | 8.0 | 9.6 | 0 | 0 |
反应后质量 | 待测 | 0 | 7.2 | 8.8 |
A. 表中待测的值为1.6 B. 物质中含有碳氢氧三种元素
C. 物质中碳氢质量比为3:1 D. 二氧化碳和水的分子个数比为1:3
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列现象不能用质量守恒定律解释的是 ( )
A. 蜡烛燃烧时慢慢变短 B. 打开盛酒精的瓶盖,一段时间后酒精的质量变小
C. 镁带燃烧后,固体的质量增加 D. 澄清石灰水在空气中露置一段时间后变重
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com