
| 次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
| 加入稀硫酸溶液的质量/克 | 100 | 100 | 100 | 100 | 100 |
| 剩余固体的质量/克 | 37 | 24.9 | a | 3 | 3 |
分析 在锌、铁和铜三种金属,锌和铁都能和硫酸反应,只有铜不和硫酸反应,所以不断加入硫酸最后剩余的是铜,也就是铜的质量为3g.由于锌铁的活动性是锌比铁活泼,根据金属反应的优先原则,锌先和硫酸反应,等到锌完全后铁才能和硫酸反应.
解答 解:在锌、铁和铜三种金属,锌和铁都能和硫酸反应,只有铜不和硫酸反应,所以不断加入硫酸最后剩余的是铜,也就是铜的质量为3g.由于锌铁的活动性是锌比铁活泼,根据金属反应的优先原则,锌先和硫酸反应,等到锌完全后铁才能和硫酸反应.
消耗等质量的硫酸消耗的锌和铁的质量为65:56,也就是当加入等质量的酸,如果是同种金属,则引起的固体质量变化相等,而现在加入第一硫酸,引起的质量变化为13g,而第二次是12.1g,说明第一次加入酸,只有锌参加了反应,第二次是锌和铁参加的反应.此时也可以分析如果100g硫酸消耗的铁的质量为$\frac{56}{65}$×13g=11.2g.而当加入第三次硫酸的时候只有铁和硫酸反应,所以可知固体在24.9g的基础上减少了11.2g,所以a=24.9g-11.2g=13.7g,根据这个分析可知继续加入100g硫酸,所以在13.7的基础上继续减少11.2g剩余2.5g,结果是剩余3g,说明硫酸过量,铁完全反应.也印证了前面分析的100g硫酸对应锌的减少量为13g,对应的铁的减少量为11.2g的结论是正确的.
计算硫酸的质量分数可以用“100g硫酸对应锌的减少量为13g“或者”100g硫酸对应的铁的减少量为11.2g“.
设100g硫酸中溶质的质量为x.
Zn+H2SO4=ZnSO4+H2↑
65 98
13g x
$\frac{65}{98}$=$\frac{13g}{x}$
x=19.6g
或者
Fe+H2SO4=FeSO4+H2↑
56 98
11.2g x
$\frac{56}{98}$=$\frac{11.2g}{x}$
x=19.6g
则硫酸中溶质的质量分数为$\frac{19.6g}{100g}×$100%=19.6%
答:(1)该50克金属混合物中含有铜 3克.
(2)其所用稀硫酸溶液的溶质质量分数为19.6%
(3)表格中“a”的值为 13.7.
点评 题目借助数据分析将金属活动性的优先原则进行运用,解题中很容易忽略,也很难理解数据变化的规律.所以要综合分析金属反应的优先原则以及反应的质量关系.


科目:初中化学 来源: 题型:实验探究题
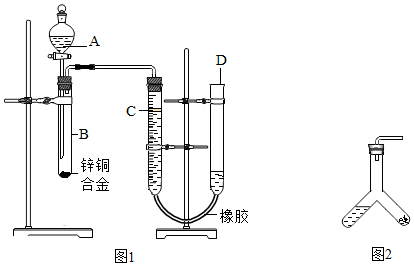
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 原子中原子核内的质子数和中子数一定相等 | |
| B. | 同种元素的原子和离子(如钠原子和钠离子)核内质子数一定相等 | |
| C. | 参加化学反应的各物质的分子总和与反应后生成的各物质的分子总和相等 | |
| D. | 化学反应前后,原子的种类、数目、质量都不变 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
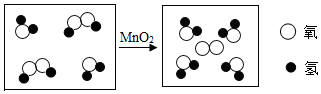
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 向试管中滴加液体时,滴管应垂悬在试管口上方,并不接触试管 | |
| B. | 为了节约药品,实验用剩的药品应放回原试剂瓶中 | |
| C. | 加热后的试管应立即用冷水冲洗 | |
| D. | 用量筒量液体时,量筒放平,视线与量筒内液体凹液面保持水平 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 水变成水蒸气时,质量保持不变 | |
| B. | 铁生锈时,固体质量增加 | |
| C. | 镁条燃烧后,所得固体质量变大 | |
| D. | 高锰酸钾受热分解后,剩余固体质量减轻 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 一个二氧化硫分子由一个硫原子和一个氧分子构成 | |
| B. | 二氧化硫由一个硫原子和两个氧原子构成 | |
| C. | 二氧化硫由一个硫元素和两个氧元素组成 | |
| D. | 一个二氧化硫分子由一个硫原子和两个氧原子构成 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| Cl- | SO42- | CO32- | NO3- | OH- | |
| Cd2+ | 溶 | 溶 | 不溶 | 溶 | 不溶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com