
食用“染色”馒头会对人体造成危害。已知铬酸铅PbCrO4中铅元素的化合价为+2价,则铬元素(Cr)的化合价为( )
A. +6 B. +4 C. +2 D. +1
A 【解析】铬酸铅的化学式为PbCrO4,其中铅元素的化合价为+2价,氧元素的化合价为-2价,设铬元素的化合价为x,根据化合价的代数和为0,+2+x+(-2)4=0,得x=+6价,故选A。科目:初中化学 来源:山东省滨州市2018年中考化学试卷 题型:单选题
小芳在配制一定溶质质量分数的氯化钠溶液时,没有按照正确的称量氯化钠。量取水的操作规程进行操作(图示为小芳操作时的读数,其它操作都正确)。小芳实际配制的氯化钠溶液的溶质质量分数(水的密度为1g/cm3)约为

A. 12.4% B. 17.2% C. 16.9% D. 12.5%
A 【解析】称量一定质量固体时应遵循左物右码的原则,如果物和砝码反放,则物的质量等于砝码的量-游码的量,所以氯化钠是实际质量为15g-2.7g=12.3g;量取一定量的液体时,应平视读数,仰视读数,读数偏小。由图可知,所量液体的实际体积为:87mL,所以实际配制的氯化钠溶液的溶质质量分数: 。故选A。查看答案和解析>>
科目:初中化学 来源:福建省泉州五校2018届九年级联考模拟卷化学试卷 题型:综合题
某实验小组利用废硫酸液制备K2SO4并研究CaSO4•2H2O加热分解的产物。
(一)K2SO4的制备

(1)将CaCO3研成粉末的目的是___________________________________。
(2)M物质的化学式为__________。
(3)反应Ⅲ中相关物质的溶解度如下表。
物质 | KCl | K2SO4 | NH4Cl | M |
溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
反应Ⅲ在常温下能实现的原因是_______________________________________。
(4)上述流程中可循环使用的物质有CO2和_____________(填写化学式)。
(二)研究CaSO4•2H2O加热分解的产物
(5)分离出的CaSO4•2H2O中常含有CaCO3,可用盐酸除去CaCO3,
该反应的化学方程式_______________________________________________。
(6)为了测定CaSO4•2H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验。注:碱石灰的主要成分为NaOH和CaO。

① 实验前首先要________________,再装入样品。装置A的作用是_________________。
② 已知:CaSO4•2H2O在160℃生成CaSO4,1350℃时CaSO4开始分解; CaCO3在900℃时分解完全。
现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将______。(填“偏大”、“偏小”或“无影响”)你认为还可选用上述的________________(选填序号)两个数据组合也可求出x:y的值。
(7)CaSO4•2H2O受热会逐步失去结晶水。取纯净CaSO4•2H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示。

则G点固体的化学式是_________________。
加快反应速率(或使反应更充分或提高原料的利用率等合理答案均给分) (NH4)2SO4 常温下K2SO4的溶解度小 CaCO3 CaCO3+2HCl=CaCl2+CO2↑+H2O 检查装置的气密性 除去空气中的CO2和H2O 偏小 b、c CaSO4•H2O 【解析】(一)(1)根据将CaCO3研成粉末,碳酸钙与硫酸接触面积更大,其目的是加快反应速率解答;(2)根据质量守恒定律分析解答;(3)...查看答案和解析>>
科目:初中化学 来源:湖北省荆州市毕业班调研考试化学试卷 题型:填空题
如图是甲、乙两种固体物质(不含结晶水)的溶解度曲线图,请根据曲线信息回答问题:

(1)t2℃时,将30 g固体甲充分溶解于50 g水中,可形成溶液的质量是______克。
(2)t1℃时,将30 g固体乙充分溶解于100 g水中,所形成溶液里溶质与溶剂的质量比是______。
(3)将t2℃时乙的不饱和溶液降温到t1℃时恰好达到饱和状态,溶质的质量分数_____(填“不变”、“变大”或“变小”)。
(4)将t2℃时等质量的甲、乙饱和溶液降温到t1℃,析出晶体质量较多的是______(填“甲”或“乙”)。
70 1:5 不变 甲 【解析】(1)t2℃时,甲物质的溶解度为40g,含义是指在t2℃时100g的水中最多能溶解40g的甲物质,故30g的甲物质可以完全溶解在100g的水中,形成的溶液的质量为130g; (2)t1℃时,乙物质的溶解度为20g,故将30g的乙物质加入到100g的水中,只能溶解20g的乙,故所形成溶液里溶质与溶剂的质量比是20g:100g=1:5; (3)将t2℃...查看答案和解析>>
科目:初中化学 来源:湖北省荆州市毕业班调研考试化学试卷 题型:单选题
己知某反应的表达式为“A+B→C+D”,若C、D分别表示盐和水,则关于该反应的说法正确的是( )
A. 反应可能放热 B. 一定有酸参加反应
C. 生成的盐一定难溶于水 D. 一定没有气体参加反应
A 【解析】根据题意,某反应的表达式为“A+B→C+D”,若C、D分别表示盐和水,据此结合酸的化学性质(与金属氧化物生成盐和水、与碱反应生成盐和水)、碱的化学性质(与非金属氧化物反应生成盐和水),进行分析判断。 【解析】 A、若该反应是中和反应,中和反应放出热量,故选项说法正确; B、该反应不一定有酸参与反应,故选项说法错误; C、生成的盐不一定难溶于水,如HCl+NaO...查看答案和解析>>
科目:初中化学 来源:湖北省黄石市2018年中考理综化学部分试卷 题型:流程题
某兴趣小组用铝箔制备A12O3及明矾大晶体,具体流程如下:
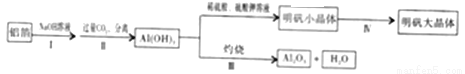
已知:明矾在水中的溶解度随着温度的升高而增大,请回答下列问题:
(1)步骤II中发生反应的化学方程式为:NaAlO2+CO2+2H2O= Al(OH)3↓+X(方程式已 配平)。X的化学式为_____________。
(2)步骤III中发生的反应,其基本反应类型为__________。
(3)写出Al(OH)3与硫酸反应的化学方程式____________。
(4)在培养明矾大晶体的过程中,其操作的先后顺序为__________。
A. 自然冷却至室温
B. 选规则明矾小晶体,并用一根细线悬挂在溶液中央
C. 配制45℃的明矾饱和溶液
(5)写出明矾的一种用途__________。
NaHCO3 分解反应 2A1 (OH)3+3H2SO4= A12(SO4)3+6H2O CBA 净水剂 【解析】根据所学知识和题中信息知,(1)步骤II中发生反应的化学方程式为:NaAlO2+CO2+2H2O= Al(OH)3↓+X。根据质量守恒定律知,X的化学式为NaHCO3。(2)步骤III中发生的反应,其基本反应类型为分解反应,反应物是一种物质,生成物是两种物质。(3)Al(OH)3...查看答案和解析>>
科目:初中化学 来源:湖北省黄石市2018年中考理综化学部分试卷 题型:单选题
现有甲、乙、丙三种金属,先将三者分别加入到稀硫酸中,只有乙金属表面有气泡生成;再将甲加入到丙的盐溶液中,无明显变化。据此判断三种金属的活动性由强到弱的顺序是
A. 甲>乙>两 B. 甲>丙>乙 C. 乙>丙>甲 D. 丙>甲>乙
C 【解析】现有甲、乙、丙三种金属,先将三者分别加入到稀硫酸中,只有乙金属表面有气泡生成,乙排在氢前面,甲和丙排在氢后面,乙比甲和丙活泼;再将甲加入到丙的盐溶液中,无明显变化,丙比甲活泼。三种金属的活动性由强到弱的顺序是乙>丙>甲。故选C。 点睛∶金属活动顺序表的应用⑴排在氢前面的金属可以与稀硫酸或盐酸反应置换出氢气,排在氢后面的金属则不能⑵排在前面金属可以把排在其后面的金属从它的盐溶...查看答案和解析>>
科目:初中化学 来源:湖北省孝感市2018年中考理综化学试卷 题型:单选题
下列图像能正确反映对应变化关系的是

A. 在一定量的硝酸银和硝酸铜的混合溶液中加入铁粉至过量
B. 用胃舒平[主要成分Al (OH)3 ]治疗胃酸过多时胃液pH的情况
C. 向盛有一定量氧化铜粉末的烧杯中不断加入稀硫酸至过量
D. 加热一定量氯酸钾和二氧化锰固体混合物
C 【解析】根据所学知识和题中信息知,A、在一定量的硝酸银和硝酸铜的混合溶液中加入铁粉至过量,铁比铜活泼,铜比银活泼,铁与硝酸银溶液反应生成硝酸亚铁和银,铁与硝酸铜溶液反应生成硝酸亚铁和铜,硝酸铜的质量分数最后应变为零,故A错误;B、用胃舒平[主要成分Al(OH)3]治疗胃酸过多时胃液pH的情况,氢氧化铝与盐酸反应生成氯化铝和水,氢氧化铝属于固体,pH值不可能超过7,故B错误;C、向盛有...查看答案和解析>>
科目:初中化学 来源:山东省潍坊市2018年中考化学试卷 题型:单选题
下列属于置换反应的是( )
A. 2H2O 2H2↑+O2↑ B. S+O2
2H2↑+O2↑ B. S+O2 SO2
SO2
C. NaOH+HCl=NaCl+H2O D. 2Al+6HCl=2AlCl3+3H2↑
D 【解析】A、该反应是一种物质反应生成多种物质,符合分解反应的特点,故是分解反应,不是置换反应,故错误; B、该反应是两种物质反应生成一种物质,是化合反应,故错误; C、该反应是酸与碱互相交换成分生成盐和水的反应,是复分解反应,故错误; D、该反应是由金属单质和酸反应生成氢气和盐,是置换反应,正确。故选D 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com