
 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
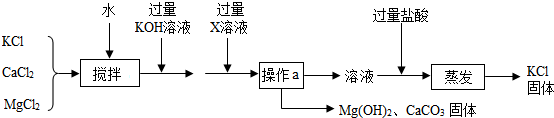
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验操作 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入适量盐酸,塞上带导管的单孔塞, 把导管插入另一试管里的石灰水中. | 有气体产生,气体使石灰水变浑浊. | 猜想2成立 |
| ②在上述反应后的试管中加少量品红溶液. | 品红溶液褪色. |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
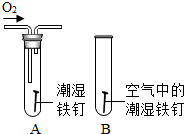
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

 | 甲 | 乙 | 丙 | 丁 |
| mg大理石 | 块状 | 块状 | 粉末状 | 粉末状 |
| mg验算(过量) | 稀盐酸 | 浓盐酸 | 稀盐酸 | 浓盐酸 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | C+O2$\frac{\underline{\;点燃\;}}{\;}$CO2 | B. | 2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C | ||
| C. | 2Na2O2+2H2O═4NaOH+O2↑ | D. | NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 单质:金刚石、水银、钢 | B. | 碱:烧碱、纯碱、熟石灰 | ||
| C. | 氧化物:水、干冰、过氧化钠 | D. | 酸:硫酸、硝酸、碳酸钙 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com