
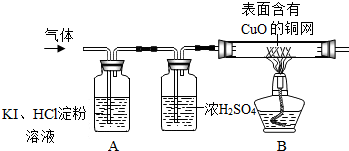
分析 (1)二氧化硫气体能使高锰酸钾溶液褪色;
(2)氧气能使带火星的木条复燃,实验室通常使用带火星的木条检验气体为氧气;
(三)装置A中的混合溶液若出现蓝色,则可说明气体中含有氧气,若不变色或无明显现象,则说明气体中不含有氧气;装置B中的氧化铜用来检验气体中的氢气,若黑色氧化铜中出现光亮红色铜,则可说明气体中含有氢气;
解答 解:(1)气体通入后,高锰酸钾溶液颜色不变,说明气体中不含能使高锰酸钾褪色的二氧化硫气体;
故答案为:无;
(2)使用带火星的木条进行检验,若木条复燃,可说明气体为氧气;
故答案为:带火星的木条;
(三)气体中没有氧气时,溶液中的KI就不能发生反应生成单质碘,没有单质碘生成淀粉溶液就不会变成蓝色;氢气在加热条件下能与氧化铜反应生成铜和水,因此,当观察到黑色铜丝变成光亮的红色时,则可说明气体为氢气;
故答案为:溶液未出现蓝色或无现象;铜网表面变红;.
点评 根据装置中所盛放药品的分析,正确判断装置所起到的作用,是准确推断装置中可能出现的现象的基础.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 水是生命的源泉,也是不可缺少的资源.
水是生命的源泉,也是不可缺少的资源.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
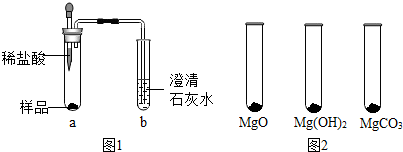
| MgO | Mg(OH)2 | MgCO3 | |
| 消耗稀盐酸的体积/mL | 10.4 | 7.2 | 5.0 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 反应中C、CO都得到氧,都是还原剂 | |
| B. | 反应前后C、Cu、O三种元素的化合价都发生了变化 | |
| C. | 反应都必须在高温的条件下才能进行 | |
| D. | 反应导出的气体都有毒,需进行处理以防止空气污染 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com