
| A. | 该反应涉及的物质都是由原子构成的 | |
| B. | FeCl3中铁元素、氯元素的质量比为1:3 | |
| C. | X的化学式为FeCl2 | |
| D. | Fe中铁元素的化合价为+3 |
科目:初中化学 来源: 题型:选择题
| A. | 原固体样品中肯定含有木炭粉 | |
| B. | 原固体样品中只混有氧化镁 | |
| C. | 恰好完全反应后溶液中水的质量为184克 | |
| D. | 所用的稀硫酸中溶质质量分数为19.6% |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
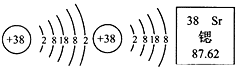
| A. | 锶的相对原子质量为87.62g | B. | 锶原子核外共有38个电子 | ||
| C. | 锶元素属于金属元素 | D. | 硫酸锶的化学式可表示为SrSO4 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 这个实验证明了水是由氧气和氢气组成的 | |
| B. | 水电解是化学变化 | |
| C. | 在水通直流电后,在阳极产生体积较大的气体 | |
| D. | 实验证明水是一种混合物 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题

查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
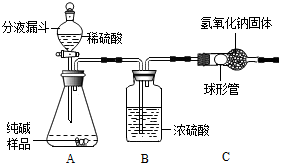
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
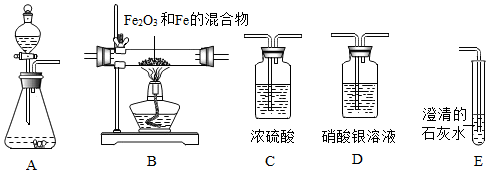
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com