
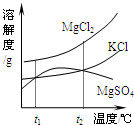
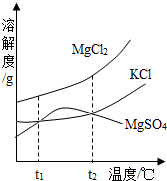
右图是NaCl、MgSO4的溶解度曲线。请回答下列问题:
加热t2℃的MgSO4饱和溶液,会看到的现象是 ;
将t1℃时MgSO4的饱和溶液升温至t3℃,溶质质量分数的变化是___________(填“变大”、“变小”或“不变”);

在t3℃时,将NaCl的不饱和溶液恒温蒸发100g水后,析出ag固体,若再继续恒温蒸发100g水,则析出固体的质量________ag(填“>”、“<”或“=”);
若要将t2℃的MgSO4饱和溶液150g稀释至10%,需加水___________g。
(1) 有固体析出 (2) 不变 (3) > (4) 350
【解析】
试题分析:(1)根据溶解度曲线可知,当温度大于t2℃时,MgSO4的溶解度随温度的升高而减小,故加热t2℃的MgSO4饱和溶液会有溶质MgSO4的析出,故可见有固体析出的现象。
(2)根据溶解度曲线可知,从t1℃升温至t3℃时,MgSO4的溶解度会先变大后变小,但最终t3℃时MgSO4的溶解度>t1℃时MgSO4的溶解度,故将t1℃时MgSO4的饱和溶液升温至t3℃时,溶液会变成不饱和溶液,由于此过程中,溶质、溶剂的质量均未变,故溶质质量分数不变。
(3)由于第一次蒸发时的溶液是不饱和溶液,故蒸发时需要先蒸发掉部分的水,使溶液变为饱和溶液(此时未有晶体析出),然后再继续蒸发,才有ag晶体析出,即相当于在t3℃时,将NaCl的饱和溶液恒温蒸发<100g的水后,析出ag固体;所以,若对该饱和溶液再继续恒温蒸发100g水,则析出固体的质量>ag。
(4)根据溶解度曲线可知,t2℃时MgSO4的溶解度是50g,根据饱和溶液的溶质质量分数=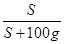 ×100﹪可知,t2℃的MgSO4饱和溶液的溶质质量分数=
×100﹪可知,t2℃的MgSO4饱和溶液的溶质质量分数=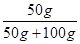 ×100﹪=33.3%;又因为稀释的过程中,改变的是溶剂的质量,而溶质的质量不变,故可设需加水的质量为xg,则有150g×33.3%=(150g+x)×10﹪,解得x=350g。
×100﹪=33.3%;又因为稀释的过程中,改变的是溶剂的质量,而溶质的质量不变,故可设需加水的质量为xg,则有150g×33.3%=(150g+x)×10﹪,解得x=350g。
考点:饱和溶液和不饱和溶液,固体溶解度曲线及其作用,有关溶质质量分数的简单计算,有关溶液的稀释的计算
点评:本题主要考查了固体溶解度曲线所表示的意义,及根据固体溶解度曲线来解决相关问题,注重培养学生的分析问题、解决问题的能力,解题的关键是要熟记和理解固体溶解度曲线及其应用,以及溶质质量分数的有关计算。


科目:初中化学 来源: 题型:
 我市濒临渤海,有较长的海岸线,海洋资源十分丰富.
我市濒临渤海,有较长的海岸线,海洋资源十分丰富.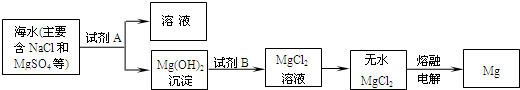
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
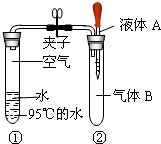
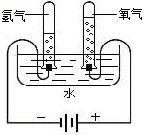
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
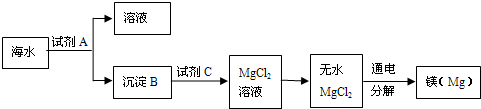
 海洋资源十分丰富.
海洋资源十分丰富.
| 实验序号 | 第一次实验 | 第二次实验 | 第三次实验 |
| 所取海水质量/kg | 100 | 100 | 100 |
| 生成沉淀质量/kg | 0.28 | 0.29 | 0.30 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
 我市濒临渤海,有较长的海岸线,海洋资源十分丰富.
我市濒临渤海,有较长的海岸线,海洋资源十分丰富.
查看答案和解析>>
科目:初中化学 来源: 题型:
碘元素对青少年智力发育影响很大,加碘盐通常在食盐中加碘酸钾(K1O3)。右图是超市销售 的一种加碘盐标签上的部分文字说明。请回答下列问题:
的一种加碘盐标签上的部分文字说明。请回答下列问题:
(1)从食用注意可知,K1O3的化学性质是 。
(2)碘酸钾中钾、碘、氧三种元素质量比为 。
(3)每袋该食盐中碘元素的质量 mg。
(4)中国营养学会推荐:一个l8岁的青年每天摄人碘元素的质量为0.15mg。假设碘的来源仅靠这种加碘食盐,该青年每天摄人这种食盐应为 g。
|
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com