
| 序号 | 化学反应 | ||||
| ① | Fe3O4+CO
| ||||
| ② | 3Fe2O3+CO
| ||||
| ③ | FeO+CO
|
| 实验内容 | 实验现象 | |
| 实验一 | 冷却后,称量剩余固体 | 剩余固体质量为1.76g |
| 实验二 | 取一部分剩余固体,用磁铁靠近 | 部分粉末能被磁铁吸引 |
| 化合物中已反应A元素质量 |
| 化合物中A元素总质量 |
| 16×3 |
| 56×2+16×3 |
| 0.64g |
| 0.72g |


科目:初中化学 来源: 题型:
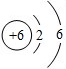
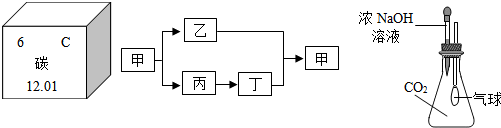
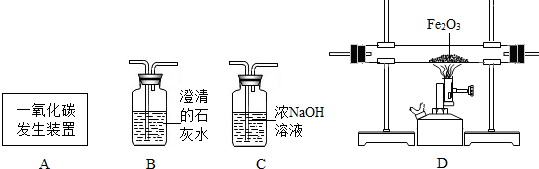
查看答案和解析>>
科目:初中化学 来源: 题型:
| 序号 | 化学反应 | ||||
| ① | Fe3O4+CO
| ||||
| ② | 3Fe2O3+CO
| ||||
| ③ | FeO+CO
|
| 实验内容 | 实验现象 | |
| 实验一 | 冷却后,称量剩余固体 | 剩余固体质量为1.76g |
| 实验二 | 取一部分剩余固体,用磁铁靠近 | 部分粉末能被磁铁吸引 |
| 化合物中已反应A元素质量 |
| 化合物中A元素总质量 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 序号 | 化学反应 |
| ① | Fe3O4+CO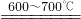 FeO+CO2 FeO+CO2 |
| ② | 3Fe2O3+CO 2Fe3O4+CO2 2Fe3O4+CO2 |
| ③ | FeO+CO Fe+CO2 Fe+CO2 |
| 实验内容 | 实验现象 | |
| 实验一 | 冷却后,称量剩余固体 | 剩余固体质量为1.76g |
| 实验二 | 取一部分剩余固体,用磁铁靠近 | 部分粉末能被磁铁吸引 |
 ;若以原固体中氧元素的转化来表达反应的转化率则该反应转化率为________.(结果用百分数表示,保留一位小数).
;若以原固体中氧元素的转化来表达反应的转化率则该反应转化率为________.(结果用百分数表示,保留一位小数).查看答案和解析>>
科目:初中化学 来源:2012-2013学年江苏省常州市九年级(上)期末化学试卷(解析版) 题型:填空题
| 序号 | 化学反应 |
| ① | Fe3O4+CO FeO+CO2 FeO+CO2 |
| ② | 3Fe2O3+CO 2Fe3O4+CO2 2Fe3O4+CO2 |
| ③ | FeO+CO Fe+CO2 Fe+CO2 |
| 实验内容 | 实验现象 | |
| 实验一 | 冷却后,称量剩余固体 | 剩余固体质量为1.76g |
| 实验二 | 取一部分剩余固体,用磁铁靠近 | 部分粉末能被磁铁吸引 |
 ;若以原固体中氧元素的转化来表达反应的转化率则该反应转化率为 .(结果用百分数表示,保留一位小数).
;若以原固体中氧元素的转化来表达反应的转化率则该反应转化率为 .(结果用百分数表示,保留一位小数).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com